В основе всех 4 типов регуляции лежит изменение конформации ферментов.
1. Путем фосфорилирования или дефосфорилирования. 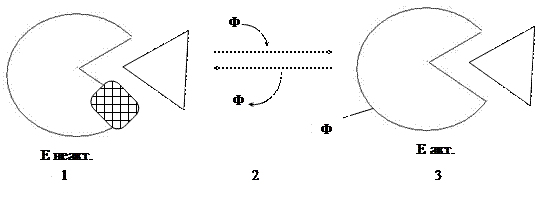
1) Неактивный фермент состоит из одной субъединицы или одной ппц
2) При присоединении остатков фосфорной кислоты к ферменту (по остаткам серина или треонина) меняется конформация фермента
3) И он становится активным (обратимая реакция)
2. Частичный протеолиз (отщепление части ппц) – необратимый тип.
 |
1) Фермент неактивный – ппц.
2) В результате отщепления части цепи изменяется конформация ферментов.
3) И он становится активным.
 Так действуют ферменты, участвующие в переваривании. Например, неактивный трипсиноген (фермент поджелудочной железы) активируется путем отщепления шести аминокислотных остатков:
Так действуют ферменты, участвующие в переваривании. Например, неактивный трипсиноген (фермент поджелудочной железы) активируется путем отщепления шести аминокислотных остатков:
3. При помощи белок-белковых взаимодействий (обратимая реакция)
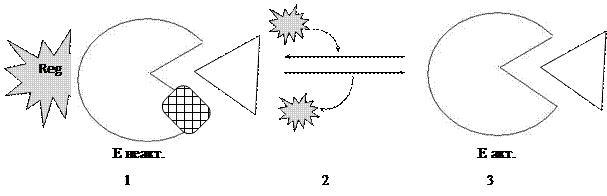
1) Неактивный фермент состоит из одной или нескольких субъединиц, которые связаны с белком-регулятором.
2) Под действием различных факторов происходит отщепление белка-регулятора, а фермент меняет конформацию.
3) Фермент активируется.
4. Аллостерическая регуляция (обратимая реакция)
1) Фермент состоит из двух или более субъединиц. Субъединицы работают согласовано.
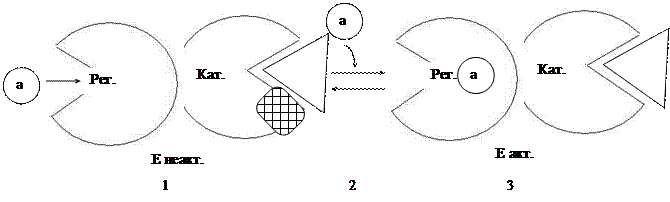 Например, к неактивному ферменту регуляторной субъединицы (с АлЦ) присоединяется активатор.
Например, к неактивному ферменту регуляторной субъединицы (с АлЦ) присоединяется активатор.
2) В результате меняется конформация регуляторной субъединицы, через место контакта субъединиц эти изменения передаются на каталитическую единицу (с АЦ), она меняет конформацию и конфигурацию АЦ.
3) Фермент активный
Так же можно подавить активность фермента ингибитором.
Например: В метаболических путях аллостерические ферменты катализируют ключевые реакции метаболизма и могут ингибироваться конечным продуктом метаболического пути. Такой вид ингибирования - обратная отрицательная связь = ретроингибирование.
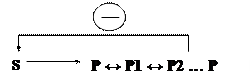 Метаболический путь – цепь последовательных биохимических реакций, в которых продукт одной реакции является субстратом для следующей реакции.
Метаболический путь – цепь последовательных биохимических реакций, в которых продукт одной реакции является субстратом для следующей реакции.
Аллостерические ферменты катализируют необратимые реакции и часто ингибируются конечным продуктом (ретроингибирование).
Изоферменты
Изоферменты – м ножественные формы фермента, которые катализируют одну и ту же реакцию, но в разных органах.
|
· Строению
· Молекулярной массе
· Электрофоретической подвижности
Например, ЛДГ (лактатдегидрогеназа) катализирует реакции ПВК ↔ лактат в разных органах.
Фермент состоит из 4 субъединиц двух типов:
 |
И существует 5 типов (изоформ) фермента
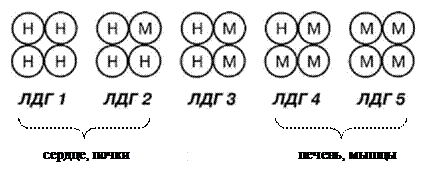 |
Методом электрофореза установлено, что ЛДГ 1 и меньше ЛДГ 2 присутствуют в сердечной мышце, в почках. ЛДГ 4 и ЛДГ 5 – в печени и мышцах.






