Алициклические углеводороды
К ним относятся циклические насыщенные и ненасыщенные углеводороды.
В зависимости от характера связей в цикле они подразделяются на следующие группы:
1.Циклоалканы (циклопарафины) имеют только простые связи между атомами углерода.
2.Циклоалкены (циклоолефины) содержат одну двойную связь.
3.Циклоалкадиены содержат 2 двойные связи.
4.Циклоалкаполидиены имеют более двух двойных связей в цикле.
5.В зависимости от количества циклов в молекуле алициклические углеводороды могут подразделяться на моноциклические, например,
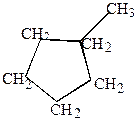
| 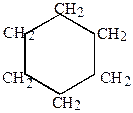
|
| метилциклопентан | Циклогексан |
и полициклические, например,

| ||
Углеводороды, содержащие в составе молекулы шестичленное кольцо с тремя двойными связями, кольцо циклогексатриена,

обладают совершенно отличными свойствами, поэтому они выделены в особый ряд ароматических углеводородов, и в этом разделе не рассматриваются.
Моноциклические насыщенные углеводороды
(циклопарафины, циклоалканы, полиметиленовые углеводороды)
Имеют общую формулу СnH2n, т.е. изомерны по составу олефинам, однако отличаются от последних тем, что не дают реакций, характерных для двойной связи. Открыты в нефти в 1883 г. В.В.Марковниковым. Классификация циклопарафинов проводится в зависимости от величины цикла:
| Ряд циклопропана | Ряд циклобутана | Ряд циклопентана | Ряд циклогексана |

| 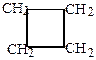
| 
| 
|
 метилциклопропан
метилциклопропан
| Нафтены (входят в состав многих нефтей) | ||
 этилциклопропан
этилциклопропан
|
До 40 атомов С в цикле.
Номенклатура циклопарафинов
По систематической номенклатуре за основу принимают углеродную цепочку цикла. Нумерацию цикла проводят, начиная с того атома углерода, который связан с наименьшим радикалом, и продолжают в сторону ближайшего с соблюдением принципа возрастающей сложности.
Например,

1,2-диметил-4-этилциклогексан
При наличии радикала с длинной и разветвленной цепью за основу можно принять самую длинную открытую цепь углеродных атомов.
Например,

3-метил-2-циклопентилпентан
Изомерия циклопарафинов
Структурная изомерия представлена изомерией углеродной цепи. По строению цепи циклопарафины могут отличаться:
1. Величиной кольца.
2. Количеством и строением боковых цепочек.
3. Взаимным расположением ответвлений.
Пространственная изомерия.
Первоначально считали, что углеводородные атомы циклов расположены в одной плоскости. Отсюда вытекало, что валентные углы в циклах равны: в циклопропане – 600С, в циклобутане – 900С, в циклопентане – 1080С, в циклогексане – 1200С.
В 1885г. А.Байер, учитывая, что для цепей открытого строения с простыми связями характерны тетраэдрические углы (109028/) высказал предположение, что при отклонении валентных углов цикла от этой величины в кольце возникает напряженность, т.е. возрастает энергия молекулы. Мерой напряженности Байер предложил считать половину разности между тетраэдрическим углом и валентным углом плоского кольца – величину 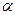 .
.
| Число атомов углерода кольца (n) | |||||
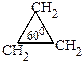
| 
| 
| 
| ||
| 24044/ | 9044/ | 0044/ | -5044/ | 
|
| Q, кДж/см | 157?5 |
По этим данным наименее напряженным должен быть цикл пятичленный. Однако при изучении теплот сгорания были получены другие данные. Наименьшей теплотой сгорания (в расчете на 1 группу СН2) обладает циклогексан.
Если учесть, что у углеводородов с открытой цепью теплота сгорания на 1 группу СН2 составляет 157,5 ккал, видно, что все циклы, кроме шестичленного, обладают напряженностью. Эти данные натолкнули на мысль, что в шестичленном кольце совсем не должно быть отклонений валентных углов от тетраэдрического. Исходя их этого, Мор в 1919г. обосновал предположение, что циклогексановое кольцо имеет неплоское строение и может принимать две формы: форму кресла (а) и форму ванны (б):

| 
| 
| 
| 
|
| (а) 95% | (б) 5% |
Обе эти формы должны быть свободны от Байеровского углового напряжения, т.к. при таком изгибе кольца валентные углы близки к тетраэдрическим. Позднее при помощи различных спектральных методов анализа показано, что, действительно, величина валентного угла в молекуле циклогексана оставляет 109028/, несколько изогнуты в пространстве также четырех- и пятичленные циклы.
Пространственная изомерия циклопарафинов включает два вида:
1.Геометрическую изомерию (цис-транс-изомерия);
2.Оптическую изомерию.
Наиболее ярко выражена пространственная изомерия у соединений с плоским строением кольца – в ряду циклопропана.
Геометрическая изомерия наблюдается при наличии у разных атомов углерода двух заместителей, которые могут различным образом располагаться относительно плоскости кольца.
Например,

| 
|
| Цис-1,2-диметилциклопропан | транс-1,2-диметилциклопропан |
Оптическая изомерия обуславливается наличием у двух замещенных производных циклопропана асимметрических атомов углерода. При этом оптическая активность наблюдается только у транс-изомеров.

| 
|
| D-изомер | L-изомер (транс-1,2-диметилциклопропан) |
Цис-изомер при наличии одинаковых заместителей не обладает оптической активностью, т.е. молекула в этом случае имеет плоскость симметрии, и наблюдается внутримолекулярная компенсация вращения плоскости поляризации.

Геометрические изомеры отличаются физическими и химическими свойствами, оптические изомеры – только направлением вращения плоскости поляризации.
Соединения с четырех- и пятичленными кольцами
Имеют почти плоское строение кольца.

| 
|






