Составим электронные формулы атомов.







 7N 1s22s22p3 валентные электроны 2s22p3; ↑ ↓ ↑ ↑ ↑
7N 1s22s22p3 валентные электроны 2s22p3; ↑ ↓ ↑ ↑ ↑





1H 1s1 валентный электрон 1s1 ↓
 |
Атом азота имеет три неспаренных электрона и четыре валентные атомные орбитали. Возбужденное состояние для него энергетически невыгодно, так как в валентном уровне нет свободных орбиталей. Валентность атома азота в соединениях может быть 3 или максимально – 4. У атома водорода один неспаренный электрон и его валентность в соединениях только 1.
Атом N является центральным, вокруг которого координируются атомы Н.
Можно записать структурную формулу молекулы NH3.
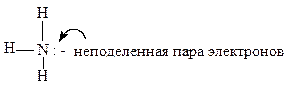
Атом азота находится в основном состоянии. Три неспаренных электрона образуют три ковалентные σ- связи по обменному механизму. В образовании связей у атома азота принимают участие одна s-орбиталь и три p-орбитали (с учетом неподеленной пары электронов). Следовательно, должна наблюдаться sp3- гибридизация валентных атомных орбиталей атома азота.
σ-Связи N-H образуются по обменному механизму перекрыванием sp3-гибридных атомных орбиталей атома азота и 1s-орбиталей атомов водорода.
sp3 –Гибридные атомные орбитали ориентированы из центра тетраэдра к его вершинам, под углом 109°28'. Одна из вершин «тетраэдра» (в направлении неподеленной электронной пары) остается свободной. Таким образом, молекула NH3 имеет геометрическую форму треугольной пирамиды, вершиной которой является атом азота, а в основании находятся атомы водорода. Валентный угол между связями HNH должен составлять 109°28'.
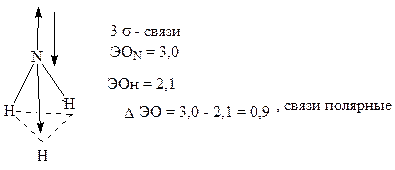
Степень ионности связи N-H находим на основании таблиц 6 и 7. Чем выше различие в ЭО, тем в большей степени cвязь приближается к ионной. Например, для связи Н-F: ΔЭО = 4-2,1 = 1,9; следовательно, связь полярно-ионная на 50%.
Рассчитаем ионность связи N-H. Значение ∆ЭО=0,9 находится между значениями 0,6 и 1,2. Разница 1,2-0,6=0,6 единиц, разница степени ионности: (25 – 7 = 18). Разница ∆ЭО в нашем случае: (0,9 - 0,6 = 0,3). На разность ∆ЭО = 0,3 приходится разность степени ионности, рассчитанная по пропорции:
 0,6 - 18 х=9.
0,6 - 18 х=9.
0,3 - х
Прибавляем 9 к меньшему значению 7 и получаем степень ионности связи N-H: (7 + 9=16%).
Так как σ - связи молекулы полярные и молекула NH3 имеет несимметричное строение, то суммарный дипольный момент молекулы не равен 0 (μ≠0), т.е. молекула NH3- полярная и ее можно представить, как диполь, в котором избыточный отрицательный заряд находится на азоте, а положительный на атомах водорода.
Теоретический валентный угол HNH (без учета гибридизации) равен 90°, но так как наблюдается sp3-гибридизация, валентный угол должен приблизиться к 109°28', справочные данные -107°.
Таблица 6. Определение степени ионности связи
| ΔЭО | 0.6 | 1.2 | 1.8 | 2.2 | 2.6 | |
| Степень ионности связи, % |
Таблица 7. Относительные электроотрицательности элементов (по Полингу)
| Н 2,2 | ||||||||||||||||
| Li 1,0 | Be 1,6 | В 1,8 | C 2,5 | N 3,0 | O 3,4 | F 4,0 | ||||||||||
| Nа 0,93 | Mg 4,3 | Al 1,6 | Si 1,9 | P 2,2 | S 2,6 | Cl 3,2 | ||||||||||
| K 0,82 | Ca 1,0 | Sc 1,4 | Ti 1,5 | V 1,6 | Cr 1,7 | Mn 1,6 | Fe 1,8 | Co 1,9 | Ni 1,9 | Cu 2,0 | Zn 1,6 | Gd 1,8 | Ge 2,0 | As 2,2 | Se 2,6 | Br 3,0 |
| Rb 0,82 | Sr 0,9 | Y 1,2 | Zr 1,5 | Nb 1,6 | Mo 2,2 | Tc - | Ru 2,2 | Rh 2,3 | Pd 2,2 | Ag 1,9 | Cd 1,7 | In 1,6 | Sn 1,8 | Sb 2,0 | Te 2,1 | I 2,7 |
| Cs 0,79 | Ba 0,9 | Pt 2,3 | Au 2,5 | Hg 2,0 | Tl 2,0 | Pb 2,3 | Bi 2,0 | PO - |
Значения, указанные для переходных металлов относятся к состоянию окисления + 2.
Таблица 8. Геометрия основных типов молекулярных структур
| Число стерео-активных электро пар | Расположение электронных пар | Число связы-вающих электр. пар | Число непо-делен-ных пар | Геометрия молекулы | Примеры |
| линейное | линейная
=Х=
линейная
| СO2, N2O, HCN | |||
| треугольное равностороннее | плоская
треугольная
 изогнутая
изогнутая
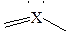
| SO3, BF3, СН2О CO32-,NO3- SO2, NO2- | |||
| тетраэдрическое | тетраэдричес-кая
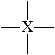 тригональная пирамидальная
тригональная пирамидальная
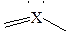 изогнутая
изогнутая
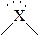
| CH4, NH4+ SO42- BF4- NH3, ClO3-, SO32- PCl3 H3O+ H2O ClO2- | |||
| тригональное бипирамидальное | тригональная бипирамидаль-ная
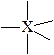 «ходульная»
«ходульная»
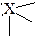 Т-образная
Т-образная
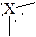 линейная
линейная
| PCl5 SbCl5 SF4 TeCl4 ClF3 BrF3 XeF2 J3- | |||
| октаэдрическое | октаэдрическая
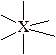 пирамидальная
квадратная
пирамидальная
квадратная
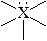 плоская квадратная
плоская квадратная
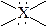
| SF6 SiF2- PF6- BrF5,ХeOF4, SbCl5 BrF4-, ХeF4 |
Задание 3 по теме:






