Студент в соответствии с номером варианта, который присваивается преподавателем, выполняет задание, которое состоит из следующих этапов:
- определение закономерности изменения энергии Гиббса реакции от температуры;
- расчет расхода реагента;
- количество реагента реакции.
По результатам ответов студент получает оценку.
Содержание отчета
Отчет по работе должен содержать:
- краткие сведения о теоретических основах равновесных и количественных закономерностей извлечения благородных металлов из руд;
- необходимые расчеты по определению закономерности изменения энергии Гиббса реакции от температуры; расчета расхода реагентов и количества реагентов реакции.
- выводы по работе.
Объем отчета 4-5 стр.
Контрольные вопросы
1. На какие вопросы, отвечает термодинамика?
2. Почему в гидрометаллургии часто можно пользоваться упрощенным уравнением 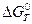 =
= 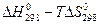 ?
?
3. Связь между 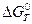 и Кр.
и Кр.
4. Почему в ряде случаев при большом отрицательном значении 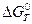 реакция практически не протекает?
реакция практически не протекает?
5. Какие дополнительные данные необходимы, чтобы однозначно сказать, какая из двух термодинамически возможных реакций идет в действительности?
6. Общий вид уравнения 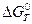 = f(T) с учетом изменения теплоемкости реагируемых веществ.
= f(T) с учетом изменения теплоемкости реагируемых веществ.
Задание: Рассчитать расход реагента и изменение энергии Гиббса в зависимости от полученного индивидуального задания.
Таблица 1 - Варианты заданий
| Задание | Реакция | Масса веществ |
| В1 | 2Au + 4NaCN + 0,5O2 + H2O = NaAu(CN)2 + 2NaOH | 100г NaAu(CN)2 |
| В2 | 2Ag + 4NaCN + 0,5O2 + H2O = NaAg(CN)2 + 2NaOH | 100г NaAg(CN)2 |
| В3 | Au + 4KCN +0,5 O2 + H2O =2KAu(CN)2 + 2KOH | 100г KAu(CN) |
| В4 | Ag + 4KCN +0,5 O2 + H2O =2KAg(CN)2 + 2KOH | 100г KAg(CN)2 |
| В5 | 4NaCN + Zn + 2H2O = Na2(CN)4 + 2NaOH + 2H2 | 100г Na2(CN)4 |
| В6 | 2NaOH + Zn = Na2ZnO2 + H2 | 100г Na2ZnO2 |
| В7 | 4KCN + Zn + 2H2O = K2(CN)4 + 2KOH + 2H2 | 100г Na2ZnO2 |
| В8 | 2KOH + Zn = K2ZnO2 + H2 | 100г K2ZnO2 |
| В9 | Ag2S + 4NaCN = 2NaAg(CN)2 + Na2S | 100г NaAg(CN)2 |
| В10 | Ag2S + 4KCN = 2KAg(CN)2 + K2S | 100г KAg(CN)2 |
| В11 | AgCl + 2NaCN = NaAg(CN)2 + NaCl | 100г NaAg(CN)2 |
| В12 | AgCl + 2KCN = KAg(CN)2 + KCl | 100г KAg(CN)2 |
| В13 | AgTe2 + 2NaCN + 2O2 + 4H2O = 2AgNa(CN)2 + 4Te(OH)2 | 100г AgNa(CN)2 |
| B14 | AuTe2 + 2NaCN + 2O2 + 4H2O = 2AuNa(CN)2 + 4Te(OH)2 | 100г AuNa(CN)2 |
| В15 | AgTe2 + 2KCN + 2O2 + 4H2O = 2AuK(CN)2 + 4Te(OH)2 | 100г AuK(CN)2 |
| В16 | 2Au + 2NaCl + SiO2 + 0,5O2 = 2AuCl + Na2SiO3 | 100г AuCl |
| В17 | 2Ag + 2NaCl + SiO2 + 0,5O2 = 2AgCl + Na2SiO3 | 100г AgCl |
| В18 | 2Au + 2NaCl + SO2 + O2 = 2AuCl + Na2SO4 | 100г AuCl |
| В19 | 2Ag + 2NaCl + SO2 + O2 = 2AgCl + Na2SO4 | 100г AgCl |
| В20 | Au + 2NaCl + S + 2O2 = AuCl + Na2SO4 | 100г AuCl |
| В21 | Ag + 2NaCl + S + 2O2 = AgCl + Na2SO4 | 100г AgCl |
Метод Резницкого. В основу метода Резницкого положена линейная зависимость стандартной теплоты образования от нормального электродного потенциала (Е) элемента, входящего в соединение в виде катиона:
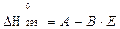
где: А, В – постоянные,
Е – нормальный электродный потенциал катиона.
Для цианидов:
 38,28- 21,55×Е0
38,28- 21,55×Е0
| Е0, В | +1,68 | +0,799 | -2,925 | -2,714 | -2,542 |
| Элемент | Au+ | Ag+ | K+ | Na+ | Te2+ |
Например, 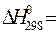 (NaCN) = 38,27 – 21,55× (-2,714)= +96,75 кДж/моль
(NaCN) = 38,27 – 21,55× (-2,714)= +96,75 кДж/моль
Метод Лагимера
| S, Дж/(К·моль) | 64,02 | 53,56 | 38,49 | 31,38 | 25,68 | 30,12 | 40,58 | 20,92 | 20,82 |
| Элемент | Au+ | Ag+ | K+ | Na+ | Te2+ | CN- | Cl- | S2- | OH- |
Например, 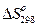 (NaCN) = 31,38 + 30,12 = 61,50 Дж/(К·моль)
(NaCN) = 31,38 + 30,12 = 61,50 Дж/(К·моль)
ЛАБОРАТОРНАЯ РАБОТА № 4






