Транспорт лекарств в организме к месту приложения их действия осуществляется жидкими тканями организма – кровью и лимфой. В крови лекарство может находиться в свободном состоянии и в состоянии, связанном с белками и форменными элементами крови. Фармакологически активным, т.е. способным проникать из крови в ткани-мишени и вызывать эффект, является свободная фракция лекарства.
Связанная фракция лекарства представляет собой неактивное депо лекарства и обеспечивает более длительное его существование в организме.
Как правило, оснóвные лекарства связываются с кислым a1-гликопротеинами плазмы крови, а кислые лекарства транспортируются на альбуминах. Некоторые лекарственные средства (гормональные, витаминные или медиаторные вещества) могут транспортироваться на специфических белках переносчиках (тироксин-связывающий глобулин, транстеритин, секс-глобулин и др.). Некоторые лекарства могут связываться и транспортироваться на ЛПНП или ЛПВП.
В зависимости от способности связываться с белками все лекарственные средства можно разделить на 2 класса:
· Класс I: Лекарственные средства, которые применяются в дозах меньших, чем число мест их связывания на белках. Такие лекарства в крови практически полностью (на 90-95%) связаны с белком и доля свободной их фракции невелика;
· Класс II: Лекарственные средства, которые применяют в дозах больших, чем число мест их связывания на белках. Такие лекарственные средства в крови находятся преимущественно в свободном состоянии и доля связанной их фракции не превышает 20-30%.
Если пациенту, принимающему лекарство из класса I, которое на 95% связано с белком (например, толбутамид) одновременно ввести другое лекарство, оно начнет конкурировать за места связывания и вытеснит часть первого лекарства. Даже если предположить, что доля вытесненного лекарства составит всего 10% уровень свободной фракции лекарства из класса I составит 5+10=15%, т.е. увеличится в 3 раза (!) и риск развития токсических эффектов у такого пациента будет весьма велик.
Если пациент принимает лекарство из класса II, которое на 30% связано с белком, то при вытеснении 10% за счет назначения другого лекарства, свободная фракция составит всего 70+10=80% или возрастет в 1,14 раза.
Таким образом, лекарства, которые в значительной мере связаны с белком обладают более длительным эффектом, но могут вызывать развитие токсических реакций, если на фоне их приема пациенту проводят назначение дополнительного лекарства, без коррекции дозы первого средства.
Некоторые лекарства находятся в крови в связанном с форменными элементами состоянии. Например, на эритроцитах переносится пентоксифиллин, а на лейкоцитах - аминокислоты, некоторые макролиды.
27. Концентрация лекарственного вещества в плазме крови как главный параметр для управления фармакотерапевтическим эффектом. Задачи, решаемые на основе этого постулата.
Основной постулат (догма) фармакокинетики: концентрация ЛВ в плазме крови детерминирует (количественно определяет) фармакологический эффект.
В большинстве случаев скорость всасывания, распределения, метаболизма и экскреции ЛС пропорциональна их концентрации в плазме крови (подчиняется закону действующих масс), поэтому зная ее возможно:
1) определить период полуэлиминации (для ЛС с кинетикой первого порядка)
2) объяснить длительность некоторых токсических эффектов ЛС (для ЛС в высоких дозах с кинетикой насыщения)
3) рассчитать загрузочную и поддерживающие дозы ЛС, необходимые для обеспечения адекватного терапевтического действия, а также скорректировать их на основе индивидуальных особенностей организма.
28. Пресистемная элиминаци и биодоступность лекарств: сущность, детерминанты, зависимость от пресистемной элиминации и качества лекарственной формы. Биоэквивалентность ЛС и её оценка
Пресистемная элиминация ЛВ – потери ЛС до попадания в общую систему циркуляции (т.е. в системный кровоток) – потери при первом прохождении (через печень).
Биодоступность (F) – полнота и скорость всасывания при внеситемных путях введения. 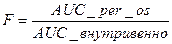 ≤ 1, где AUC – площадь под фармакокинетической кривой. Биодоступность отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата.
≤ 1, где AUC – площадь под фармакокинетической кривой. Биодоступность отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата.
Детерминанты биодоступности:
1) скорость всасывания
2) полнота всасывания - недостаточная абсорбция ЛС вследствие его очень высокой гидрофильности или липофильности, метаболизма бактериями кишечника при энтеральном введении и т.д.
3) пресистемная элиминация – биотрансформация в печени (в основном)
При высокой пресистемной элиминации биодоступность ЛС низкая (нитроглицерин при энтеральном введении). Биодоступность определяется и качеством лекарственной формы, например, использование сублингвальных таблеток и ректальных суппозиториев помогает ЛС избежать пресистемной элиминации.
Биодоступность > 70% считается высокой, ниже 30% - низкой.
Биоэквивалентность
– означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности. Доказательство биоэквивалентности генерического лекарственного препарата его брендовому аналогу – необходимое условие регистрации любого генерического препарата.
Основным критерием биоэквивалентности является отношение площадей под фармакокинетической кривой для двух изучаемых лекарственных средств, а также отношение максимальных концентраций этих лекарств в крови пациента:
Считают, что допустимыми колебаниями этих параметров является диапазон 0,8-1,2 (т.е. биодоступность двух сравниваемых лекарств не должна различаться более чем на 20%).
Если генерический лекарственный препарат является небиоэквивалентным его брендовому аналогу то данное лекарство не может быть зарегистрировано и разрешено к применению. Показателен пример с препаратами пиридинолкарбамата. Это средство было представлено на рынке в виде таблеток пармидин (Россия), продектин (Венгрия) и ангинин (Япония)[1]. Разница показателей биодоступности между пармидином и ангинином составляла 7,1%, тогда как та же разница для продектина и ангинина была 46,4%. Неудивительно, что доза продектина должна была быть в 2 раза больше дозы ангинина, чтобы оказать сопоставимое терапевтическое действие.
Доказательств биоэквивалентности не требуется для отдельных лекарственных препаратов: дигоксина, фенитоина, оральных контрацептивов. Это связано с тем, что обеспечить равную биодоступность для этих средств сложно даже в пределах одного производителя – иногда разные серии препарата, изготовленные на одном заводе могут иметь значимые колебания показателей биодоступности.
! Следует помнить, что биоэквивалентность лекарств еще ничего не говорит об их терапевтической эквивалентности.






