Электросталеплавильный процесс, более совершенный способ выплавки и производится в электродуговых и индукционных печах. Этот метод применяется для получения высококачественных сталей.
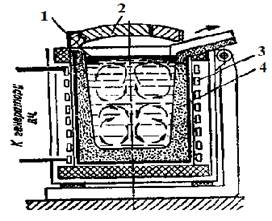
В электродуговых печах (рис. 3.5.) для нагрева и плавления металла используется тепловая энергия излучения электрической дуги возбуждаемой между электродами и металлом, легко регулируемая изменением параметров тока, с возможностью создавать окислительную, восстановительную, нейтральную атмосферу или вакуум.
По мере плавки электроды опускаются вглубь шихты, заваленной в печь. Электроды изготавливают из графита. Общая продолжительность процесса 3 – 4 часа.
 |
Рис. 3.5. Принципиальная схема электродуговой печи:
1 – корпус печи; 2 – съемный свод; 3 – электроды; 4 – электрододержатели; 5 – рабочее окно; 7 – желоб для выпуска плавки; 8 – слой шлака; 9 – металл; 10 – сектор для наклона печи.
Основным сырьем для плавки стали служит стальной и железный лом, легированные металлоотходы, чугун, шлакообразующие компоненты (известняк, известь, шамотный бой), окислители (окалина), науглероживатели (кокс), легирующие добавки, раскислители.
Для ускорения процессов в шихту вдувают газообразный кислород под давлением 0,8 – 1,0 МПа через фурму.
В электропечах выплавляют в больших количествах нержавеющие стали, жаропрочные и специальные стали, а также сложнолегированные сплавы, содержащие тугоплавкие элементы.
 |
Индукционная электроплавка применяется в основном для выплавки в относительно небольших количествах разнообразных высококачественных сталей и специальных сплавов. Нагрев и расплавление шихты в этих печах происходит за счет тепла, выделяемого индуктированным в ней током (рис. 3.6.).
Рис. 3.6. Принципиальная схема индукционной печи:
1 – металл; 2 – крышка; 3 – индуктор; 4 – тигель.
Производство цветных металлов и сплавов
Производство алюминия
Сырьем для производства алюминия являются алюминиевые минералы. К ним относятся бокситы, каолины, нефелины и некоторые сорта глин. Основным видом сырья являются бокситы. Боксит представляет собой сложный минерал, основу которого составляет свободный гидрат окиси алюминия. Кроме этого компонента в боксит входит еще более 40 различных элементов.
Производство металлического алюминия слагается из двух основных процессов — получения окиси алюминия из руды (глинозема) и получения металла из окиси методом электролиза.
 |
Получение металлического алюминия из глинозема. Основным методом получения металлического алюминия из глинозема является электролиз расплава, представляющего собой раствор окиси алюминия в криолите (Na3AlР6).
Рис. 3.7. Принципиальная схема электролизера для получения алюминия:
1 – железный кожух; 2 – теплоизоляционная футеровка; 3 – угольная
набойка; 4 – электролит; 5 – анодные шины; 6 – расплавленный металл;
7 – угольные электроды; 8 – криолит; 9 – катодные шины.
Процесс электролиза в электролизерах (рис. 3.7.) протекает при температуре 950–1000° С. Выделяющийся на катоде алюминий накапливается на дне ванны. Напряжение в электролизерах 4–6 В. Сила тока в современных электролизерах достигает 80–160 кА. Образующийся алюминий накапливается на подине электролизера, откуда он периодически выпускается через летку (через 2–3 дня). Полученный таким методом металл содержит 99,5–99,7% А1. Такой металл называется первичным. Для получения более чистого металла, который применяется в ряде областей, первичный алюминий подвергают рафинированию.
При правильном процессе проведения электролиза расход материалов на 1 т первичного алюминия составляет: около 2 т глинозема; 0,6 т угольных электродов; 0,1 т криолита и до 18000–19000 кВт∙ч электроэнергии.
Рафинирование первичного алюминия. В ряде областей техники необходимо применение алюминия высокой степени чистоты. В качестве примера можно назвать изготовление химической аппаратуры, электролитических конденсаторов; нанесение покрытий на поверхности, отражающие свет; изготовление архитектурных деталей, требующих высокой коррозионной устойчивости и т.д. Для таких областей требуется металл с содержанием Аl свыше 99,99%. Такой металл получают электролитическим рафинированием.
Сущность этого метода заключается в анодном растворении технического сплава алюминия, при котором анодом служит технический сплав. В качестве электролита применяется расплав, состоящий из хлористых и фтористых солей бария, алюминия и натрия. Чистый алюминий при этом выделяется на катоде и всплывает на поверхность электролита.
Производство титана
Титан – металл с плотностью 4,5 г/см3 и температурой плавления 1680° С. Особая ценность этого металла заключается в его большой удельной прочности и высокой коррозионной устойчивости. Этот металл нашел широкое применение в авиационной промышленности.
Основная масса титана находится в земной коре в виде окислов типа МеО∙ТiO2, где Ме – Fе, Са, Мg, Мn и др. В наиболее чистом виде титан встречается в природе в виде двуокиси (ТiO2), которая имеет три модификации: рутил, брунит, анатаз. Основными рудами промышленного значения являются ильменит (Fе ТiO3), титаномагнетит (смесь ильменита с окислами железа) и рутил.
Из титановых концентратов в результате их переработки по различным методам получают два основных вида продукции – двуокись титана ТiO2 и четыреххлористый титан Т1С14. Получение двуокиси титана из руд осуществляется путем восстановительной переплавки руды, причем в качестве восстанавливающего компонента применяют антрацит, каменный уголь; в качестве флюса при этом используют в ряде случаев магнезит. Четыреххлористый титан получают непосредственным воздействием хлора на техническую двуокись титана, получаемую из ильменита или титаномагнетита вышеуказанным способом или же хлорированием рутила. Полученный четыреххлористый титан загрязнен различными примесями и, в частности, хлоридами железа, алюминия и др. в виде взвесей. Эти примеси обычно удаляют центрифугированием. Растворенные примеси удаляют вакуумной дистилляцией, ректификацией и другими способами.
Получение металлического титана осуществляется различными способами, основным из которых является металлотермическое восстановление четыреххлористого титана или двуокиси титана.
При восстановлении TiС14 в качестве восстановителей применяют магний или реже натрий. Использование магния обеспечивает наибольший выход металла и наибольшую экономическую эффективность процесса. Содержание титана в конечном продукте колеблется в пределах 98,5—99,0%. В качестве примесей в продукте присутствуют Mg,Сl, Н2, Fе и некоторые другие элементы (менее 1%). После обработки порошка в вакууме удается почти полностью удалить водород.
При восстановлении двуокиси титана восстановление осуществляется кальцием или гидридом кальция.
Кроме методов металлотермического восстановления может быть использован электролиз как прямой метод получения титана из расплава титановых солей, но этот вариант не получил пока промышленного применения и находится в стадии лабораторной разработки.
Весьма перспективен метод плавки титана с помощью электронного луча достаточно высокой мощности. Этот метод активно развивается в последние годы; он обеспечивает получение весьма чистого металла, поскольку при воздействии электронного луча из металла эффективно удаляются газы (азот, кислород, водород). Современная техника выплавки титана позволяет получить слитки массой более 12 т.
Литой металл или металл, полученный по методу порошковой металлургии, обрабатывается далее давлением (прокаткой, ковкой, волочением, экструзией) для получения листа, проволоки, прутков, фасонного профиля и других изделий.
Производство меди
Медь – металл красноватого цвета с плотностью 8,96 г/см3 и температурой плавления 1083° С. Медные руды встречаются в земной коре в основном в виде различных комплексных соединений, в состав которых кроме меди входят еще свинец, цинк, сурьма, мышьяк, золото, серебро.
Основными рудами меди являются сернистые – медный колчедан или халькопирит СuFеS2, медный блеск Сu2S, борнит Сu5FеS4, или окисленные – куприт Сu2О и малахит СuСО3∙Сu(ОН)2. Медные руды перед поступлением в плавку проходят обогащение.
Производство меди осуществляется по двум методам – пирометаллургическому и гидрометаллургическому. Технологический процесс получения меди по пирометрическому методу складывается из следующих операций: обжиг руды, плавка на штейн, получение черновой меди, рафинирование.
Обжиг имеет своим назначением частичное удаление серы. Эта операция производится при температуре около 1000° С с помощью воздуха. В процессе обжига образуется сернистый газ, который используется для сернокислотного производства.
Плавка на штейн может осуществляться в двух вариантах – в шахтных (ватержакетных) или отражательных печах. Более совершенным является второй вариант. При температуре около 900° С происходит взаимодействие между сульфидами и окислами меди с образованием полусернистой меди Сu2S и сернистого железа FеS. Полусернистая медь Сu2S и сернистое железо FеS образуют штейн, а пустая порода, флюс и закись железа переходят в шлак. Флюсом в этом процессе служит кварцит или известняк. Производительность печи колеблется в пределах 2–6 т/сут с 1 м2 пода печи.
Получение черновой меди осуществляется путем продувки расплавленного штейна в конвертерах. Образовавшаяся закись меди вступает во взаимодействие с остатками сернистой меди, в результате чего образуется медь. Полученная медь является «черновой», она содержит около 2% различных примесей, которые не перешли в шлак. Такая медь подвергается рафинированию огневым способом, то есть продувкой расплавленной меди воздухом. Продукт, получаемый таким образом, содержит до 99,7% Сu. Для получения более высокой степени чистоты вместо огневого применяют электролитическое рафинирование.
Электролитическое рафинирование проводят в ваннах, в которые заливают электролит, состоящий из водного раствора серной кислоты (15% Н2SО4) и раствора медного купороса (12–15% СuSО4∙5H2О). Анодами служат пластины черновой меди, а катодами листовая электролитическая медь. Напряжение тока при электролизе лежит в пределах 0,20–0,34 В, а применяемая плотность 160–210 А/м2; расстояние между центрами одноименных электродов 100–120 м.м. Выход по току в этом процессе лежит в пределах 90–95%.
Гидрометаллургический способ получения меди используется в основном для извлечения меди из окисленных бедных руд. Сущность способа заключается в том, что рудное сырье подвергается обработке слабым раствором серной кислоты, в результате чего образуется раствор сернокислой меди СuSО4. Медь из этого раствора извлекается либо электролизом, либо воздействием железного лома. Полученная таким способом медь подвергается переплавке в пламенных печах и рафинированию вышеописанными способами.






