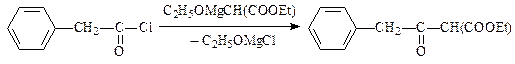Ацилирование ареновпо Фриделю-Крафтсу (синтез ароматических кетонов) может быть представлено схемой:
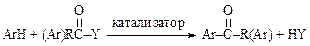
Ацилирующими агентами являются, в основном, карбоновые кислоты, их ангидриды и хлорангидриды.
Реакция родственна алкилированию по Фриделю-Крафтсу, используется для изменения углеродного скелета молекулы, идет по механизмуэлектрофильного замещения, но в отличие от алкилирования, реакция ацилирования необратимая:
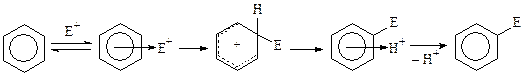
Катализаторы ацилирования— те же вещества, что и при алкилировании: протонные и апротонные кислоты, оксид алюминия, силикагель и др.
Механизм образования электрофильных частиц:
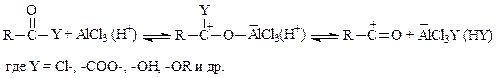
В результате взаимодействия ацилирующих агентов с катализатором образуются электрофильные частицы: во-первых, биполярный комплекс, который является более слабым, но более вероятным реагентом, чем свободный ацилий-катион; во-вторых, катионы ацилия [RC+=O «RCºO+], которые значительно стабильнее, чем алкилкатионы (за счет более равномерного распределения электронного облака по частице).
Соли ацилия выделены и охарактеризованы. Примером может служить борфторид ацетилия CH3CO+BF4–. Их генерируют как кислоты Льюиса, так и минеральные кислоты. Органические кислоты в среде минеральных кислот превращаются в ионы ацилия практически нацело.
Однако, даже в самых благоприятных условиях атакующими частицами будут, вероятно, не вышеперечисленные, а их комплексы с анионами или молекулами растворителя.
Количество кислоты Льюиса должно быть не менее 1 моль на моль субстрата, так как помимо своей основной функции они взаимодействуют с образовавшимся кетоном и выводятся из сферы реакции вместе с продуктом:
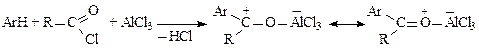
Если по каким-либо причинам кетон остается в сфере реакции, он образует с катализатором или ацилий катионом вторичную электрофильную частицу, способную взаимодействовать с субстратом, что приводит к образованию побочных продуктов реакции (спиртов):
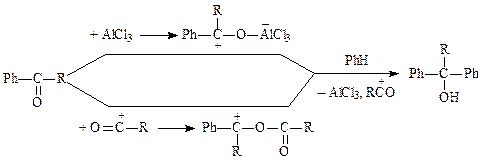
В отличие от алкилирования, ацилирование аренов не сопровождается полиацилированием, т.к. образующийся кетон менее активен, чем субстрат:
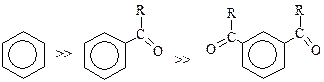
Ацилий катион более стабилен, чем алкил катион, и реакция необратимая, поэтому изомеризация реагентов и продуктов реакции не происходит. Однако, при разветвленном радикале реагента и низкой скорости ацилирования может отщепиться СО, и образующийся при этом карбокатион алкилирует арен:
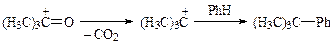
С-ацилирование аренов хлорангидридами кислот широко применяется в синтезе лекарственных веществ. Хлорангидриды кислот — самые активные ацилирующие агенты, но малодоступные, нестабильные, дорогие и самые токсичные и агрессивные.
Условия реакции (температура, время, катализатор) зависят от активности субстрата и хлорангидрида. При этом дезактивированные арены, содержащие карбонильные, нитро-, циано- и другие производные карбоксильной группы, а также пиридины и аналогичные циклы в реакцию не вступают.
При активном субстрате и активном ацилирующем агенте реакцию можно вести и без катализатора, как это делают при получении препарата изадрина из группы катехоламинов:
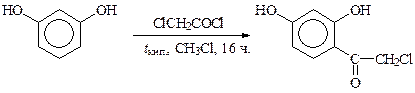
Однако чаще всего синтез кетонов осуществляют в присутствии сильного катализатора хлорида алюминия при низких температурах. Так, некоторые методы получения эфедрина включают стадии ацилирования бензола хлорангидридами пропионовой и 2,2-дихлорпропановой кислот:
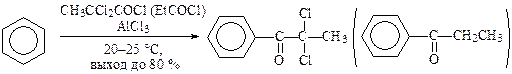
Активированные бензолы ацилируются при более низких температурах и с большим выходом. Например, взаимодействие бензо-1,4-диоксана с 3-хлор-пропаноилхлоридом и 4-бутаноилхлоридом в присутствии AlCl3 (синтезы пирроксана и бутироксана) идет при температуре 2—8 °С с выходом до 90 %:
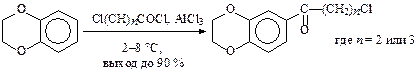
Необходимо учитывать также, что выход продукта сильно зависит от активности и особенности строения ацилирующего агента. Например, в синтезе пирроксана он достигает 90 %, а при использовании 4-хлорбутирилхлорида — только около 60 %.
Аналогично реагируют и небензоидные ароматические системы, например, нафталин:
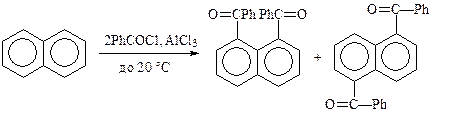
Хлорид цинка является менее активным катализатором, поэтому при его использовании реакция идет в более жестких условиях. Так, в производстве отечественного транквилизатора феназепама сначала ацилируют аминогруппу п- броманилина при 100—160 °С (выделяющийся хлороводород сильно затрудняет реакцию N-ацилирования), а затем в реакционную массу загружают хлорид цинка, поднимают температуру до 190—198 °С и ацилируют бензольное кольцо:
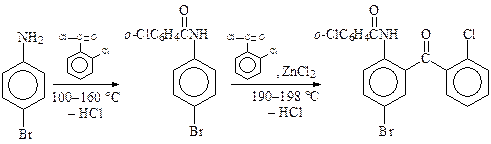
Повышенная температура при С-ацилировании, вероятно, объясняется пространственными факторами. Объемистые заместители в кольце препятствуют атаке большой электрофильной частицы в орто - положение.
С-ацилирование аренов ангидридами кислот встречается значительно реже, т.к. с субстратом реагирует только половина молекулы реагента, что является существенным недостатком метода. В связи с этим в промышленности используют, в основном, уксусный и фталевый ангидриды, как наиболее дешевые и доступные.
Уксусным ангидридом можно ацилировать и ацидофобные пятичленные гетероциклы с одним гетероатомом. Однако, если катализаторами служат протонные кислоты (например, фосфорная), выход продукта низкий. Значительно лучшие результаты достигаются при использовании в качестве катализаторов кислоты Льюиса (например, хлорид олова IV):
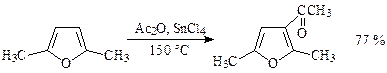
Реакции фталевого ангидрида с активными аренами проводят в присутствии хлорида цинка, например, в синтезе фенолфталеина:
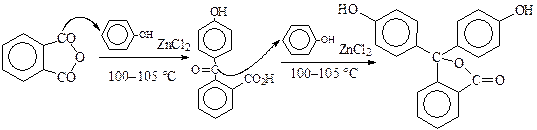
Синтез фенолфталеина проводят при 100—105 °С. При этом образовавшийся кетон гидроксиалкилирует вторую молекулу фенола.
При ацилировании бензола, его гомологов, нафталина, хлорбензола и других, близких к ним по реакционной способности, аренов используют более активный катализатор. Например, в синтезе бензоилбензойных кислот, которые служат исходным сырьем для синтеза антрахинона и его производных, а также ряда препаратов, например, хлорталидона, используют фталевый ангидрид в присутствии хлорида алюминия, который берут в избытке (2—2,5 моль на моль фталевого ангидрида). Эти реакции имеют большое промышленное значение:

Также как хлорбензол, с фталевым ангидридом могут взаимодействовать бензол, толуол, нафталин и др.
С-ацилирование карбоновыми кислотами из-за их малой активности встречаяется редко. Этот метод применяют в синтезе антрахинона из бензоилбензойных кислот с использованием серной кислоты в качестве катализатора:

Кроме кислот, катализатором может быть хлорид цинка (синтез гептилрезорцина):
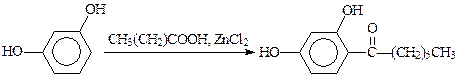
Ацилирование по Гаттерману-Коху(синтез ароматических альдегидов). Хлорангидрид муравьиной кислоты нестабильное соединение, поэтому в реакциях Фриделя-Крафтса не применяется. Однако соответствующий ему ацилий ион образуется при пропускании безводных оксида углерода (II) и хлористого водорода в смесь арена, хлоридов алюминия и меди (I) и реагирует с ареном по механизму электрофильного замещения SE:
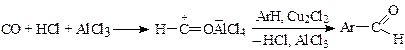
В реакцию вступают ароматические соединения, активность которых в реакциях SE не ниже галогенбензолов (конденсированные полициклические углеводороды, полиалкилбензолы и др.). Фенолы не реагируют. В ароматическое ядро вступает лишь одна формильная группа, почти исключительно в пара-положение к имеющемуся заместителю.
Выход альдегидов при 25—60 °С обычно составляет около 50—60 %, но с увеличением давления (до 3—9 МПа) он повышается до 90 %.
Реакция Вильсмейера(синтез ароматических альдегидов). В качестве реагентов используют диметилформамид, фенилметилформамид или N-формилпиперидин, (которые так же, как и реагенты в реакции Фриделя-Крафтса, относятся к ацильным соединениям). Катализатором является хлорокись фосфора. В случае соединений, чувствительных к кислотам, POCl3 можно заменить хлористым бензоилом. Взаимодействуя с катализатором, реагент образует электрофильную частицу, которая замещает атом водорода в арене по механизму SE и после гидролиза превращается в альдегидную группу:
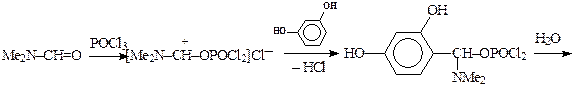
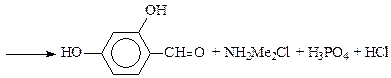
Субстратами являются активированные ароматические и гетероароматические соединения (в том числе 5-членные ацидофобные гетероциклы), а также некоторые олефины. Реакция используется в производстве сарколизина, синтезе 5-метил-фурфурола и др. альдегидов:
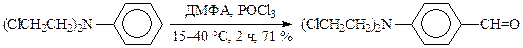
Реакция Реймера-Тимана(синтез ароматических гидроксиальдегидов). Реагентами являются фенолы и хлороформв щелочном растворе. При взаимодействии хлороформа со щелочью образуется дихлоркарбен, который, являясь электрофилом, реагирует с фенолом по SE-механизму с образованием геминального дихлорида. Далее галогенид гидролизуется с образованием гидроксиальдегида.
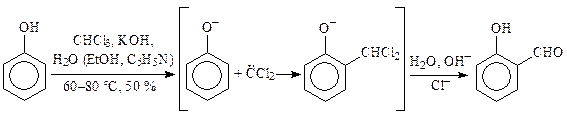
Субстратом могут быть замещенные фенолы с заместителями первого рода, нафтолы и другие активные арены.
Реакция Кольбе-Шмидта(синтез ароматических гидроксикислот) представляет собой С-ацилирование фенолятов ангидридом угольной кислоты (двуокисью углерода). В настоящее время считают, что реакция проходит через стадию образования s-комплекса:
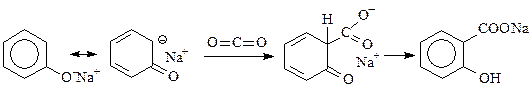
Процесс проводят в автоклаве, снабженном мощной лопастной мешалкой и специальной рубашкой для обогрева паром высокого давления. Безводный фенолят натрия нагревают до 180 °С и в автоклав под давлением вводят диоксид углерода. При этом образуется салицилат натрия.
Салициловая кислота является сырьем для получения целого ряда лекарственных препаратов (натрий салицилата, ацетилсалициловой кислоты, салициламида, метилсалицилата, фенилсалицилата и дифлунизала), которые проявляют противовоспалительное, жаропонижающее и анальгетическое действие.
Кроме фенолов в эту реакцию вступают также и аминофенолы. Так из м -аминофенола получают п -аминосалициловую кислоту (синтез противотуберкулезного препарата ПАСК):
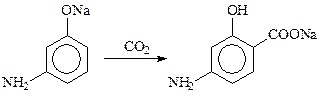
Ацилирование циклоалкенов и алкенов. Электрофильные частицы, образующиеся в условиях реакции ацилирования аренов по Фриделю-Крафтсу, могут взаимодействовать с алкенами и циклоалкенами по механизму электрофильного присоединения. Образующиеся при этом β-замещенные карбонильные соединения малоустойчивы, и при определенных условиях отщепляют галогеноводород, воду и т.д. Поэтому при взаимодействии алкенов с ацильными соединениями наряду с продуктами присоединения, образуются и продукты ацилирования (продукты замещения атома водорода ацильной группой):
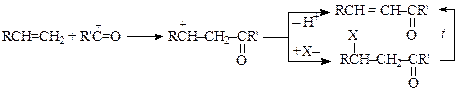
Во многих случаях продукт присоединения может быть основным.
В синтезах биологически активных веществ применяется и ацилирование по sp3-гибридному атому углерода. При этом необходимо, чтобы участвующая в реакции С–Н связь обладала кислотными свойствами. Так, в некоторых методах синтеза метилбензилкетона в производстве фенамина используется следующая схема ацилирования малонового эфира: