5. Раствор, содержащий 34,0 г AgNO3 смешивают c раствором, содержащим такую же массу NaCl. Bесь ли нитрат серебра вступит в реакцию? Сколько граммов AgC1 получилось в результате реакции?
6. Какой заряд ядра и сколько электронов, протонов, нейтронов в атомах неона и криптона?
7. Напишите электронную и графическую конфигурации атома радия. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: F2O.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
K2CO3 + HCl = KCl + H2O + CO2
10. Сколько граммов HCl содержится в 255 мл 7,2%-ного раствора HCl (ρ = 1,035 г/мл)?
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 26.
2. Распространенность химических элементов.
Вариант 27
Задачи
1. Вычислите относительную атомную массу никеля, зная, что масса атома никеля равна 97,94 × 10-24 г, атомная единица массы равна 1,66 × 10-24 г.
2. Рассчитайте количество вещества, содержащееся в 8,5 г сульфида натрия.
3. Вычислить молекулярную массу бензола, зная, что масса 600 см3 его паров при 87 °С и давлении 83, 2 кПа равна 1.30 г.
4. Какая масса природного известняка, содержащего 90 % (масс.) СаСО3 потребуется для получения 7,0 т негашеной извести?
5. К раствору, содержащему 0,20 моля FеС13, прибавили 0,24 моля NаОН. Сколько молей Fе(ОН)3 образовалось в результате реакции и сколько молей FeС13 осталось в растворе?
6. Закончить уравнение ядерной реакции: 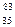 Br ® … +
Br ® … +  n.
n.
7. Напишите электронную и графическую конфигурации атома скандия. Определите к какому семейству он относится.
8. Изобразитеграфически формулы соединений и определите валентности и степени окисления элементов: С12O3.
9. Вычислить pH раствора, в котором концентрация ионов H+ в моль/л равна 4,1×10–3.
10. Напишите полное и сокращенное ионное уравнение для реакции
Рb(NО3)2+ KI ®PbI2 + KNO3.
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 27.
2. Смешанные соединения, эвтектика.
Вариант 28
Задачи
1. Рассчитайте массу атома калия, зная, что 1/12 массы атома углерода равна 1,66 × 10-24 г.
2. Сколько моль кислорода содержится в 7,6 г мела.
3. Во сколько раз этан тяжелее водорода?
4. Определить эквивалент и эквивалентную массу оксидов азота (II) и (V).
5. Смешано 7,3 г хлороводорода c 4,0 г аммиака. Сколько граммов NH4C1 образуется? Найти массу оставшегося после реакции газа.
6. Закончить уравнение ядерной реакции:  Cr +
Cr +  D ®
D ®  n+ …
n+ …
7. Напишите электронную и графическую конфигурации атома калия. Определите к какому семейству он относится.
8. Изобразитеграфически формулы соединений и определите валентности и степени окисления элементов: AlCl3.
9. Вычислить pH раствора, в котором концентрация ионов OH- в моль/л равна 5,5×10–6.
10. Сколько граммов вещества следует взять для приготовления 1 л 0,8 М раствора сульфата калия?
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 28.
2. Полупроводники и диэлектрики.
Вариант 29
Задачи
1. Вычислите относительную атомную массу бериллия Ве. Масса атома Ве равна 14,94 × 10-24 г, а атомная единица массы составляет 1,66 × 10-24 г.
2. Чему равна масса 0,25 моль плавикового шпата CaF2.
3. Сколько молекул газа содержится в 1 м3 газа при 32°С в космосе при давлении 133,3×1013 кПа.
4. Определить формулу углеводорода, содержащего 82,76 % углерода и 17,24 % водорода. 2,24 л этого углеводорода в газообразном состоянии имеют массу 5,8 г.
5. 5,10 г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74 л Н2, измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
6. Закончить уравнение ядерной реакции:  А1 +
А1 +  H ® … +
H ® … +  Не
Не
7. Напишите электронную и графическую конфигурации атома хлора. Определите к какому семейству он относится.
8. Изобразитеграфически формулы соединений и определите валентности и степени окисления элементов: P2O5.
9. Вычислить pH раствора, в котором концентрация ионов H+ в моль/л равна 1,2×10–7.
10. Сколько граммов вещества следует взять для приготовления 1 л 0,8 М раствора карбоната лития?
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 29.
2. Химические источники тока.
Вариант 30
Задачи
1. Определите чему равна относительная атомная масса олова. Масса атома олова равна 197,54 × 10-24 г, 1/12 массы атома углерода равна 1,66 × 10-24 г.
2. Определите количество вещества 5,8 г гидроксида кальция.
3. Чему равна относительная молекулярная масса газа, если при н. у. масса 1 л газа 0,9 г?




