5. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
6. Записать уравнение ядерной реакции: 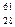 Ni +
Ni +  H ®… +
H ®… +  n
n
7. Напишите электронную и графическую конфигурации атома сурьмы. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: Ca3(PO4)2.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
Mg(NO3)2 + Na3PO4 = Mg3(PO4)2 + NaNO3
10. При выпаривании 50 г раствора получили 5 г твердого остатка. Вычислите массовую долю растворенного в растворе вещества.
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 21.
2. Общая характеристика и свойства солей.
Вариант 22
Задачи
1. Чему равна масса атома кремния, если атомная единица массы составляет 1,66 × 10-24г.
2. Сколько граммов оксида магния содержится в 2 моль твердого MgO.
3. Газ массой 30,3 г заполнил сосуд вместимостью 15 л при температуре 180С. Давление газа внутри сосуда составляет 122 кПа. Рассчитайте молярную массу газа.
Определить эквивалент и эквивалентную массу дихромовой кислоты.
5. Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5 % углерода, 36,4 % кислорода и 9,1 % водорода, зная, что плотность ее паров по водороду равна 44.
6. Закончить уравнение ядерной реакции: 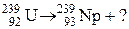
7. Напишите электронную и графическую конфигурации атома молибдена. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: K2O2.
9. Выразить концентрацию 1,185 М водного раствора хлорида алюминия с плотностью 1,129 г/мл через массовую долю, моляльность, нормальность и мольные доли.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
H2S + CuSO4 = CuS + H2SO4
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 22.
2. Теория сильных электролитов Дебая и Гюккеля.
Вариант 23
Задачи
1. Найти относительную атомную массу алюминия, учитывая, что масса атома Al равна 44,82 × 10-24 г, а 1/12 массы атома углерода составляет 1,66×10-24г.
2. Какое количество вещества содержится в 2,5 г хлорида натрия?
3. Определите число молекул газа, который заполняет сосуд вместимостью 190,4 л. Давление газа в сосуде равно 180 кПа, температура 37°С.
4. Найти молекулярную формулу вещества, содеpжащего (по массе) 93,75 % углерода и 6,25 % водорода, если плотность этого вещества по воздуху равна 4,41.
5. Найти массу серной кислоты, необходимую для полной нейтрализации 20 г гидроксида натрия.
6. Записать уравнение ядерной реакции: 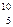 В +
В +  n ® … +
n ® … +  Не
Не
7. Напишите электронную и графическую конфигурации атома циркония. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: NH4C1.
9. Сколько граммов хлорида калия необходимо взять для приготовления
2 кг раствора с массовой долей вещества 10%.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
FeCl3 + KOH = Fe(OH)3 + KCl
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 23.
2. Типы межмолекулярного взаимодействия.
Вариант 24
Задачи
1. Определите массу атома лития, учитывая, что атомная единица массы составляет 1,66 × 10-24 г.
2. Какова масса пяти моль гидроксида натрия?
3. Стеклянный сосуд, заполненный азотом, имеет массу 206,6 г; тот же сосуд, заполненный неизвестным газом, имеет массу 207,2 г. Масса сосуда, из которого откачаны газы, равна 202,4 г. Определите молярную массу неизвестного газа (азот и неизвестный газ находятся в сосуде при одинаковых условиях).
4. При сгорании 4,3 г углеводорода образовалось 13,2 г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молeкулярную формулу вещества.
5. При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г СО2 и 0,36 г Н2О. После превращения всего брома, содержащегося в навеске, в бромид серебра, получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
6. Масса ядра атома некоторого изотопа равна 181 у.е. В электронной оболочке атома 73 электрона. Указать какой это элемент и сколько протонов и нейтронов содержится в ядре атома.
7. Напишите электронную и графическую конфигурации атома висмута. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: K2Cr2O7.
9. Вычислите массу соли и воды, которые необходимо взять для приготовления 1 кг раствора. Массовая доля соли в растворе 6%.
10. Выразить концентрацию водного раствора нитрата серебра через молярность, нормальность, моляльность и мольные доли, если массовая доля вещества 50 %, плотность раствора 1,668 г/мл.
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 24.
2. Общая характеристика комплексных соединений.
Вариант 25
Задачи
1. Вычислите относительную атомную массу марганца (масса атома марганца равна 91,3 × 10-24 г, 1/12 массы атома углерода 1,66 × 10-24 г).
2. Какое количество моль содержится в 12,7 г сульфата кальция.
3. Некоторый газ объемом 2,8 л (объем приведен к нормальным условиям) поместили в сосуд, который в отсутствие газов имел массу 110,3 г. Масса сосуда с газом равна 115,8 г. Вычислите относительную плотность газа по воздуху.
4. Массовая доля кислорода в высшем оксиде элемента V группы периодической системы Д.И. Менделеева составляет 16,06%. Определите, что это за элемент.
5. К раствору, содержащему 10 г Н2SО4, прибавили 9 г NаОН. Какую реакцию (кислую или щелочную) имеет полученный раствор?
6. Закончить уравнение ядерной реакции: 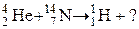
7. Напишите электронную и графическую конфигурации атома цезия. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: CrO3.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
AgNO3 + Na2S = Ag2S + NaNO3
10. Сколько граммов вещества следует взять для приготовления 3 л 0,1 М раствора KCl?
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 25.
2. Понятие о двойном электрическом слое.
Вариант 26
Задачи
1. Определите массу атома азота, если известно, что атомная единица массы равна 1,66 × 10-24 г.
2. Найдите массу 2,5 моль хлорида натрия.
3. Чему равна относительная молекулярная масса газа, если при н. у. 5 г газа занимают объем 2 л?






