5. Сколько граммов соли хлорида магния MgCl2 образуется при действии 18,25 г хлороводородной кислоты НС1 на 4 г оксида магния МgО?
6. Какой заряд ядра и сколько электронов, протонов, нейтронов в атомах магния и лития?
7. Напишите электронную и графическую конфигурации атома стронция. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: Н2S.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
KF + H2O = HF + KOH
10. Сколько граммов хлорида магния необходимо взять для приготовления 1 кг раствора с массовой долей вещества 15%.
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 10.
2. Аморфное состояние вещества.
Вариант 11
Задачи
1. Чему равна молярная масса гипса CaSO4 × 2 Н2О?
2. Найти число атомов водорода в 11,8 г гидроксида железа (III).
3. Чему равна относительная молекулярная масса газа, если при н. у. плотность по водороду равна 8?
4. Найти простейшую формулу соединения, которое содержит 40% меди, 20% серы, 40% кислорода.
5. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2 % (масс.).
6. Относительная атомная масса элемента бора составляет 10,811. Известно, что бор имеет два природных нзотопа: 10В и 11В, Определите массовую долю каждого из изотопов в природном боре.
7. Напишите электронную и графическую конфигурации атома кремния. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: SO3.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
А1Вr3+АgNО3 ® Al(NO3)3 + AgBr
10. Какова масса фенолята брома С6Н5ОBr, полученного при взаимодействии 2 моль брома с раствором фенола С6Н5ОН, масса которого 0,05 кг, массовая доля фенола в нем 0,94?
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 11.
2. Строение молекул и свойства воды.
Вариант 12
Задачи
1. Вычислите относительную молекулярную массу периодата натрия NaIO4.
2. Сколько молекул содержится в сероводороде массой 3,4 г.
3. Какова относительная молекулярная масса газа, если масса 1л его при н. у. 2,86 г?
4. Какую массу железа можно получить из 2 т железной руды, содержащей 94 % (масс.). Fe2O3?
5. При взаимодействии соляной кислоты с 1,20 г сплава магния c алюминием выделилось 1,42 л водорода, измеренного при 23 °С и давлении 100,7 кПа. Вычислить процентный состав сплава (по массе).
6. Элемент астат (изотоп 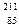 At) был получен облучением изотопа висмута
At) был получен облучением изотопа висмута  Bi a-частицамя. Напишите уравнение ядерной реакции.
Bi a-частицамя. Напишите уравнение ядерной реакции.
7. Напишите электронную и графическую конфигурации атома ртути. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: SO2.
9. Выразить концентрацию 30% -го водного раствора хлорида алюминия (III) через молярность, нормальность, моляльность и мольные доли, если его плотность равна 1,242 г/мл.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
Mg + HCl = МgCl2 + H2
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 12.
2. Жесткость воды и способы ее устранения.
Вариант 13
Задачи
1. Вычислите относительную молекулярную массу железного купороса FeSO4 × 7Н2О.
2. Какова масса одной молекулы воды?
3. Во сколько раз оксид углерода (IV) CO2 тяжелее гелия?
4. Соединение содержит углерод (54,5%), кислород (36,34%) и водород. Это соединение массой 0,39 г при 27 °С и давлении 1,013.105 Па имеет объем 220 мл. Найдите молекулярную формулу соединения.
5. К раствору, содержащему 68 г AgNO3, прилили раствор, содержащий такую же массу NаС1. Какова масса AgC1, полученного в результате реакции?
6. Какой заряд ядра и сколько электронов, протонов, нейтронов в атомах азота и йода?
7. Напишите электронную и графическую конфигурации атома германия. Определите к какому семейству он относится.
8. Определить валентностьэлементов в соединении и изобразите его графическую формулу: Н2SО4.
9. Сульфат натрия массой 10 г растворили в 250 мл воды. Плотность воды принять равной 1 г/мл. Определить массовую долю растворенного вещества.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
FeBr3+ NаОН ® Fe(OH)3 + NaBr
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 13.
2. Энергия Гиббса, энергия Гельмгольца и их изменения при химических процессах.
Вариант 14
Задачи
1. Найдите молярную массу кристаллической соды Na2CO3 × 7Н2О.
2. Найдите массу двух молекул хлорида натрия.
3. Определите массу при н. у. 0,5 л водорода.
4. Kарбонат кальция pазлагаeтся при нагревании на СаО и СО2. Какая масса природного известняка, содержащего 90 % (масс.) СаСО3 потребуется для получения 7,0 т негашеной извести?
5. K раствору, содержащему 6,8 г А1С13, прилили раствор, содержащий 5,0 г КОН. Найти массy образовавшегося осадка.
6. Закончить уравнение ядерной реакции: 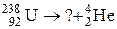
7. Напишите электронную и графическую конфигурации атома серебра. Определите к какому семейству он относится.
8. Определите степень окисления атомов кислорода в О2.
9. Рассчитайте массу раствора соляной кислоты, массовая доля хлороводорода в котором составляет 3,65%, если известно, что при реакции этого раствора с карбонатом натрия выделилось 0,1 моль оксида углерода (IV).
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
CaCl2 + Na3PO4 = Ca3(PO4)2 + NaCl
Вопросы
1. Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 14.
2. Молекулярность и порядок реакции.
Вариант 15
Задачи
1. Вычислите молярную массу асбеста 3MgO × 2SiO2 × 2H2O.
2. Сколько атомов кислорода содержится в 7,5 г мела?
3. Количество вещества углекислого газа равно 2 моль. Найти давление 60 л газа при 15 0С.




