Направление самопроизвольного протекания реакции, в том числе и ОВР, определяется по знаку изменения свободной энергии Гиббса (Δ G 0х.р). Если в результате реакции свободная энергия системы убывает (Δ G 0х.р<0), то такая реакция термодинамически разрешена.
Для окислительно-восстановительных реакций существует взаимосвязь между изменением свободной энергии и электродвижущей силой (ЭДС):
Δ G 0х.р = -nF Δ Е 0. (3)
В этом уравнении n- число электронов, участвующих в ОВР, F 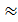 96500Кл/моль= =26,8 А∙час/моль – число Фарадея (эту величину часто называют одним Фарадеем), Δ Е – ЭДС окислительно-восстановительной системы.
96500Кл/моль= =26,8 А∙час/моль – число Фарадея (эту величину часто называют одним Фарадеем), Δ Е – ЭДС окислительно-восстановительной системы.
Условие самопроизвольности реакции Δ G 0х.р<0. В ур. (3) n и F -константы, следовательно, окислительно-восстановительная реакция термодинамически разрешена, если Δ Е >0.
В свою очередь, ЭДС рассчитывается как разность потенциалов окислителя (Е ок) и восстановителя (E восс): Δ Е = Е ок – E восс > 0. Из этого соотношения следует, что ОВР будет протекать самопроизвольно в прямом направлении, если Е ок > E восс.
Реальные ОВР начинают протекать самопроизвольно с заметной скоростью, если ЭДС системы превышает 0,4 В.
Пример 6. Для реакции
2KBr + PbO2 + 4HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2H2O
установить направление возможного протекания ее при стандартных условиях.
Решение. Запишем уравнение реакции в ионно-молекулярной форме:
2Br- + PbO2 + 4H+ = Pb2+ + Br2 + 2H2O.
Затем представим его в виде полуреакций с указанием табличных значений ОВ-потенциалов:
2Br- - 2 ē = Br2 E 0(Br2/Br-) = 1,065 В,
восстановитель
PbO2 + 4H+ + 2 ē = Pb2+ + 2H2O E 0(Pb2+/PbO2)= 1,449 В
Окислитель
Потенциал окислителя Е 0окбольше, чем потенциал восстановителя Е 0восс, следовательно, приведенная реакция будет самопроизвольно протекать слева направо.
Задания
1. Методом ионно-электронных уравнений подберите коэффициенты в следующих окислительно-восстановительных реакциях. Укажите окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается?
1) Al + K2Cr2O7 + H2SO4→ Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
2) Al + KMnO4 + H2SO4→ Al2(SO4)3 + MnSO4 + K2SO4 + H2O
3) MnO2 + KClO3 + KOH→ K2MnO4 + KCl + H2O
4) Bi2O3 + Br2 + KOH→ KBiO3 + KBr + H2O
5) SnCl2 + K2Cr2O7 + HCl → SnCl4 + CrCl3 + KCl + H2O
6) MgI2 + H2O2 + H2SO4→ I2 + MgSO4 + H2O
7) FeSO4 + KClO3 + H2SO4→Fe2(SO4)3 + KCl + H2O
8) KNO2 + K2Cr2O7 + H2SO4→ KNO3 + Cr2(SO4)3 + K2SO4 + H2O
9) MnO2 + O2 + KOH→ K2MnO4 + H2O
10) SO2 + FeCl3 + H2O→ H2SO4 + FeCl2 + HCl
11) H2S + K2Cr2O7 + H2SO4→ S + Cr2(SO4)3 + K2SO4 + H2O
12) H2SO3 + HIO3→ H2SO4 + HI
13) Zn + KMnO4 + H2SO4→ ZnSO4 + MnSO4 + K2SO4 + H2O
14) KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
15) SO2 + KMnO4 + H2O → K2SO4 + MnO2 + H2SO4
16) KI + KMnO4 + KOH → I2 + K2MnO4 + H2O
17) MnO2 + H2SO4→ MnSO4 + O2 + H2O
18) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
19) Na2SO3 + KMnO4 + KOH → KNO3 + K2MnO4 + Na2SO4 +H2O
20) K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O
21) NaCrO2 + H2O2 + NaOH→ Na2CrO4 + H2O
22) P + HNO3 + H2O → H3PO4 + NO
23) KMnO4 + H2S + H2SO4 → S + MnSO4 + K2SO4 + H2O
24) Fe2O3 + KNO3 + KOH→ K2FeO4 + KNO2 + H2O
25) I2 + KOH → KI + KIO3 + H2O
26) KIO3 + H2O2 + H2SO4→ O2 + I2 + K2SO4 + H2O
27) Al + KOH + H2O →K[Al(OH)4] + H2
28) SnCl2 +KMnO4 + HCl → SnCl4 + MnCl2 +H2O
29) Cl2 + KI + KOH → KCl + KIO3 + H2O
30) SnCl2 +FeCl3 → SnCl4 + FeCl2
2. Методом электронно-ионных уравненийсоставьте полные уравнения реакций, учитывая, что либо окислитель, либо восстановитель являются также и средой. Обоснуйте на основании стандартных окислительно-восстановительных потенциалов возможность протекания данных реакций.
1) KI + H2SO4/конц/→ I2 + H2S + K2SO4 + H2O
2) KBr + H2SO4/конц/→ Br2 + S + K2SO4 + H2O
3) NaBr + H2SO4/конц/→ Br2 + SO2 + Na2SO4 + H2O
4) Mg + H2SO4/конц/→ MgSO4 + S + H2O
5) Al + H2SO4/конц/→ Al2(SO4)3 + H2S + H2O
6) Cu + H2SO4/конц/→ CuSO4 + SO2 + H2O
7) Ag + H2SO4/конц/→ Ag2SO4 + SO2 + H2O
8) HCl/конц/ + MnO2→ Cl2 + MnCl2 + H2O
9) HCl/конц/ + KMnO4→Cl2 + MnCl2 + KCl + H2O
10) HCl/конц/ + PbO2→ Cl2 + PbCl2 + H2O
11) HCl/конц/ + CrO3 → Cl2 + CrCl3 + H2O
12) HCl/конц/ + K2Cr2O7→ Cl2 + CrCl3 + KCl + H2O
13) Zn + H2SO4/конц/ → ZnSO4 + H2S + H2O
14) CuS + HNO3→ S + Cu(NO3)2 + NO + H2O
15) Cu2O + HNO3→ Cu(NO3)2 + NO + H2O
16) CuS + HNO3/конц/→ H2SO4 + Cu(NO3)2 + NO2 + H2O
17) FeS + HNO3/конц/→ Fe(NO3)2 + H2SO4 + NO2 + H2O
18) MnS + HNO3→ S + NO + Mn(NO3)2 + H2O
19) FeSO4 + HNO3→ Fe2(SO4)3 + Fe(NO3)3 + NO2 + H2O
20) MnS + HNO3/конц/→H2SO4 + NO2 + Mn(NO3)2 + H2O
21) Ag + HNO3/конц/→ AgNO3 + NO2 + H2O
22) Zn + HNO3→ Zn(NO3)2 + NO + H2O
23) Mg + HNO3/очень разб./→ Mg(NO3)2 + NH4NO3 + H2O
24) Fe + HNO3→ Fe(NO3)3 + NO + H2O
25) S + HNO3→ H2SO4 + NO
26) H2S + HNO3→ S + NO2 + H2O
27) Cu + HNO3/разб/→ Cu(NO3)2 + NO + H2O
28) Sn + HNO3/конц/→ H2SnO3 + NO2 + H2O
29) Fe + H2SO4/конц/→ Fe2(SO4)3 + SO2 + H2O
30) K2S + HNO3→ S + NO + KNO3 +H2O
3. Окислительно- восстановительная реакция выражается ионным уравнением. Укажите, какой ион является окислителем, какой – восстановителем. Составьте ионно-электронные и молекулярные уравнения.
1) Bi + NO3– + H+ → Bi +3 + NO + H2O
2) Fe+2 + ClO3– + H+ → Fe+3 + Cl– + H2O
3) Cr+3 + BiO3– + H+ → Bi +3+ Cr2O72- + H2O
4) SO2 + Cr2O72- + H+ → Cr+3 + SO42-+ H2O
5) Cl– + MnO4–+ H+ → Cl2 + Mn+2 + H2O
6) H2O2 + MnO4–+ H+ → O2 + Mn+2 + H2O
7) I– + NO2– + H+ → I2 + NO + H2O
8) Br–+ Cr2O72- + H+ → Cr+3+ Br2+ H2O
9) I– + H2O2 + H+ → I2 + H2O
10) Cl2 + OH– → Cl– + ClO3–+ H2O
11) H2S + MnO4–+ H+ → S + Mn+2 + H2O
12) Cl– + MnO2 + H+ → Cl2 + Mn+2 + H2O
13) Mg + NO3– + H+ → Mg +2 + NH4+ + H2O
14) ClO3–+ SO32- + + H+ → Cl–+ SO42- + H2O
15) NO2– + MnO4–+ H+ → NO3– + Mn+2 + H2O
16) Br2 + OH– → Br– + BrO3–+ H2O
17) Sn+2 + BrO3– + H+ → Br2+ Sn+4+ H2O
18) Cu + NO3– + H+ → Cu +2 + NO2 + H2O
19) Cr2O72- + H+ + Fe+2 → Cr+3+ Fe+3 + H2O
20) Br– + MnO4–+ H+ → Br2 + Mn+2 + H2O
21) Pb + NO3– + H+ → Pb +2 + NO + H2O
22) Mn+2 + ClO3–+ OH– → MnO42–+ Cl–+ H2O
23) Bi + NO3– + H+ → Bi3+ + NO + H2O
24) Cr2O72– + I– + H+ → Cr3+ + I2 + H2O
25) CrO2- + Br2 + OH-→ CrO4 2– Br- + H2O
26) SO32– + Ag2О + OH– → SO42– + Ag + H2O
27) Fe2+ + MnO4– + H+ → Fe3+ + Mn2+ + H2O
28) MnO4– + I– + H+ → I2 + Mn2+ + H2O
29) MnO4– + SO3- + H2O → MnO2 + SO42- + OH-
30) MnO4– + OH– +SO32– → SO42– + MnO42– + H2O






