1. Бактериологический (рис. 43).
2. Серологический.

Рис. 43. Схема микробиологического исследования при брюшном тифе и паратифах в разные периоды заболевания. I - 1-й период исследования (гемокультура); II - 2-й период исследования (реакция Видаля); III - 3-й период исследования (копрокультура)
Ход исследования
Первый день исследования

Первый день исследования
Второй день исследования
Вынимают чашки из термостата (инкубация 18-24 ч) и просматривают выросшие колонии невооруженным глазом и при помощи лупы. Несколько (5-6) подозрительных колоний выделяют на среду Олькеницкого или Рассела. Посев производят следующим образом: снятую колонию осторожно, не задевая края пробирки, вносят в конденсационную жидкость, затем штрихами засевают всю скошенную поверхность среды и делают укол в глубину столбика для выявления газообразования. Укол следует производить в центр агарового столбика.
Пробирки с посевами ставят в термостат. Если исследуемый материал был посеян на среду обогащения, то через 18-24 ч производят высев со среды обогащения на чашки с дифференциальными средами. Дальнейшее исследование ведут по общей схеме.

Таблица 32. Рост сальмонелл на дифференциально-диагностических средах
1 (На месте снятых колоний остается черный след (изменяется цвет среды).)
Третий день исследования
Вынимают пробирки с посевами из термостата и просматривают характер роста.
В состав комбинированных сред входят лактоза, глюкоза, иногда мочевина и индикатор. Расщепление глюкозы происходит только в условиях анаэробиоза. Поэтому скошенная поверхность среды при расщеплении глюкозы не изменяется, а столбик окрашивается в цвет, соответствующий индикатору. Бактерии, расщепляющие лактозу и мочевину, изменяют цвет всей среды.
Если выделенные культуры сбраживают лактозу или расщепляют мочевину, меняя цвет всей среды, то они не являются сальмонеллами и можно дать отрицательный ответ.
Культуру, расщепляющую только глюкозу, подвергают дальнейшему изучению: делают мазки, окрашивают их по Граму и микроскопируют. При наличии в мазках грамотрицательных палочек изучают их подвижность и ферментативные свойства.
Подвижность можно определить в висячей капле или в раздавленной капле, а также по характеру роста в полужидкой среде Гисса или в 0,2% агаре. При наличии подвижности при посеве уколом рост на среде диффузный, среда мутнеет.
Для выявления ферментативной активности производят посев на среды Гисса, МПБ, пептонную воду. В пробирки с последними средами опускают (под пробку) индикаторные бумажки для определения индола и сероводорода. Делают также посев на лакмусовое молоко.
Четвертый день исследования
Учитывают биохимическую активность по результату ферментации углеводных и других сред (см. табл. 33).
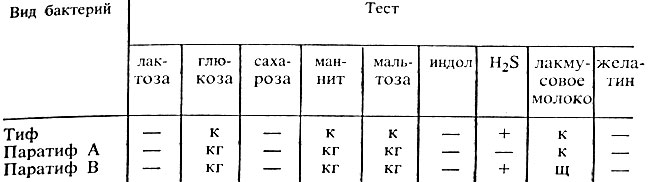
Таблица 33. Ферментативные свойства сальмонелл
Примечание. к - образование кислоты; кг - образование кислоты и газа; щ - щелочение; + наличие свойства; - отсутствие свойства.
Определив морфологические, культуральные и ферментативные свойства выделенной культуры, необходимо провести анализ антигенной структуры (табл. 34).

Таблица 34. Сокращенная схема антигенной структуры сальмонелл (по Кауфману - Уайту)
Серологическую идентификацию сальмонелл начинают с реакции агглютинации на стекле с поливалентной О-сывороткой А, В, С, D, Е. При отсутствии агглютинации выделенную культуру испытывают с поливалентной О-сывороткой к редким группам сальмонелл. При положительной реакции с одной из сывороток культуру испытывают с каждой О-сывороткой, входящей в состав поливалентной, для определения О-серогруппы. Установив принадлежность культуры к О-группе, определяют ее Н-антигены с сыворотками первой, а затем второй фазы (табл. 35).

Таблица 35. Антигенная структура возбудителей брюшного тифа и паратифов
Культуру сальмонелл тифа испытывают также с Vi-сывороткой. Возбудители брюшного тифа, содержащие Vi-антиген, испытывают Vi-фагами (их 86). Определение фаготипа имеет большое эпидемиологическое значение (см. рис. 43).
Методика фаготипирования. 1-й метод. В чашки Петри наливают 20-25 мл агара и подсушивают с открытыми крышками в термостате. Дно чашки делят на секторы. На каждом секторе пишут название фага. Изучают 4-6-часовую бульонную культуру, так как она содержит больше Vi-антигена. На поверхность агара наносят 8-10 капель бульонной культуры и стеклянным шпателем растирают ее по поверхности агара. Чашки с посевами подсушивают с открытыми крышками в термостате. На каждый сектор наносят каплю соответствующего типового фага. После подсыхания капель чашки ставят в термостат на 18-24 ч. Результат учитывают невооруженным глазом или с помощью лупы через дно чашки.
Наличие лизиса культуры одним или несколькими типовыми фагами позволяет определить принадлежность выделенного штамма к определенному фаготипу.
2-й метод. На питательную среду культуру наносят каплями. На каждую каплю после высыхания культуры в термостате наносят каплю типового фага. Ставят в термостат.
Степень лизиса выражают по четырехкрестной системе.
Контрольные вопросы
1. Какой материал исследуют при брюшном тифе, паратифах и токсикоинфекциях?
2. В каком периоде заболевания используют метод выделения гемокультуры?
3. В каком периоде заболевания брюшным тифом и паратифами исследуют испражнения и мочу?
4. На какие дифференциально-диагностические среды производят посев исследуемого материала?
5. Какие среды используют для накопления сальмонелл?
6. Что определяют монорецепторными О-сыворотками и что монорецепторными Н-сыворотками?
Задание
1. Изучите по табл. 32 характер роста сальмонелл на дифференциальных средах. Посмотрите у преподавателя чашки с посевом сальмонелл тифа на средах Эндо, Плоскирева, висмут-сульфитном агаре. Зарисуйте колонии цветными карандашами и покажите преподавателю.
2. Возьмите у преподавателя культуры сальмонелл, О- и Н-монорепторные сыворотки. Поставьте реакцию агглютинации на стекле. Учтите реакцию и покажите преподавателю.
Задача
Выделенная культура дала положительную реакцию агглютинации с О-сывороткой 4. С какими Н-сыворотками надо поставить реакцию агглютинации, если Вы думаете, что это культура сальмонелл паратифа В?






