Классическая статистика. Функция распределения Максвелла. Барометрическая формула. Распределение Больцмана.
Закон равномерного распределения энергии по степеням свободы молекул.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/ 2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы

где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:

Внутренняя энергия для произвольной массы т газа.

где М — молярная масса, n — количество вещества.
С редняя длина свободного пробега молекул и эффективный диаметр молекулы.





Классическое распределение по скоростям (Максвелла):
Справедливо для всех частиц:

dN – число частиц, попадающих в определенный интервал скоростей.
N – число всех частиц.
f(V) – функция распределения по скоростям
dV – элементарный объем скоростей.
Рассмотрим функцию распределения по скоростям в сферической системе координат:


 - функция распределения Максвелла.
- функция распределения Максвелла.










Величина А (амплитуда вероятности) находится из условия нормировки:
 - условие нормировки
- условие нормировки
 ;
; 
Аналогично находим j(vy) и j(vz):


тогда 


Барометрическая формула. Распределение Больцмана.










Первое закон термодинамики.
Внутренняя энергия системы. Теплоемкость вещества. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам в идеальном газе. Адиабатический процесс.

Внутренняя энергия газа

Теплоемкость вещества.


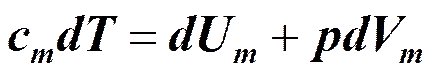
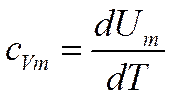






Применение первого начала термодинамики к изопроцессам.
Изохорный процесс (V =const).


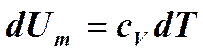

Изобарный процесс (p =const).
Для работы изобарного расширения



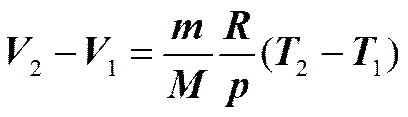

Изотермический процесс (T =const).





Адиабатический процесс.






Уравнения Пуассона:




12.
II закон термодинамики. Тепловые двигатели.
Обратимые и необратимые процессы. II закон термодинамики в формулировках Томсона и Клаузиуса. Энтропия. Статистический смысл энтропии. Теорема Нернста. Круговые процессы (циклы). Цикл Карно. КПД тепловой машины. Термодинамические T-S диаграммы. Теорема Карно.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимые процессы — это идеализация реальных процессов.




