Розчини – це гомогенні системи, що складаються з розчинника та розчиненої речовини.
Дисперсна фаза – це розчинена речовина.
Дисперсійне середовище – це розчинник.
Ступінь дисперсності – це ступінь подрібненості розчиненої речовини.
Класифікація розчинів за ступенем подрібненості:
1) істинні розчини – розміри розчинених частинок менше 1 нм;
2) колоїдні розчини – розміри частинок 1 – 100 нм;
3) грубодисперсні розчини (зависі) – частинок більше 100 нм:
Ø емульсії (рідка фаза) – креми, мазі, молоко;
Ø суспензії (тверда фаза) – зависі мулу або крейди у воді
Ø аерозолі.
Золі – це колоїдні розчини, в яких колоїдні частинки знаходяться в рідкому середовищі.
Будова міцели (колоїдної частинки):
Міцела – елементарна колоїдна частинка, яка містить нерозчинне в даному дисперсійному середовищі ядро.
Будова міцели AgI в розчині КІ
AgNO3 + KI → AgI + KNO3

Будову даної міцели можна представити формулою:

Методи отримання колоїдних розчинів:
· Дисперсійні методи (методи подрібнення твердих тіл до частинок колоїдного розміру):
Ø механічне подрібнення (розтирання та подрібнення в спеціальних млинах);
Ø метод електричного розпилення (пропускають струм між електродами, зануреними у воду. Електроди виготовлені з того матеріалу, з якого готують колоїдний розчин: Pt, Au, Ag та інші);
Ø метод з використанням ультразвуку.
· Методи конденсації (агрегація частинок у більш крупні частинки:
Ø заміна розчинника
Наприклад, золь прополісу: 30г прополісу + 100г спирту 96% (розчиняється),
збовтують на протязі тижня, а потім фільтрують і
додають воду (не розчиняється) → молекули
переходять в колоїдні частинки.
Використання: пити або полоскати при хронічних захворюваннях.
Ø конденсація з пари крізь холодну воду, що містить стабілізатор можна отримати золь Hg, S, Se);
Ø хімічна конденсація (методи засновані на хімічній реакції між речовинами, яка призводить до утворення нерозчинної або малорозчинної речовини).
Наприклад, отримання червоного золю Au:
а) відновлення Au з його солі формальдегідом
2NaAuO2 + 3HCOH + Na2CO3 → 2Au + 3HCOONa + NaHCO3 + H2O
б) утворення колоїдних частинок
 | |||||
 |  | ||||
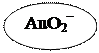
 або [Au]m · nAuO2– · (n–x)Na+ x– xNa+
або [Au]m · nAuO2– · (n–x)Na+ x– xNa+
Методи очищення колоїдних розчинів
Мета очищення: зменшення числа непотрібних іонів та молекул, що адсорбовані на поверхні колоїдних частинок, з метою підвищення стійкості колоїдних розчинів.
Діаліз – це метод, заснований на властивостях напівпроникливої мембрани пропускати домішки іонів та молекул малих розмірів та затримувати колоїдні частинки. Процес проводять в апараті – діалізаторі:

Схема діалізатора
(потребує багато часу і недостатньо ефективний)
 схема електродіалізатора
схема електродіалізатора
(не потребує багато часу, ефективна
ступінь очищення)
Ультрафільтрація – процес фільтрування колоїдних розчинів крізь напівпроникливі мембрани (колоїдні розчини залишаються на фільтрі, а фільтрат з розчиненими електролітами проходить крізь фільтр).
Властивості колоїдних розчинів
· Молекулярно-кінетичні властивості:
Броунівський рух.
2. Осмотичний тиск (набагато менший, ніж для істинних розчинів, тому що розмір частинок більший → кількість менша → концентрація менша)
|
ν – часткова концентрація (число частинок в одиниці об’єму)
3. Дифузія – це повільний процес вирівнювання концентрації частинок по всьому об’єму розчину під впливом теплового (броунівського) руху.
4. Седиментація – це процес зсідання колоїдних частинок в розчині або в газоподібному середовищі під дією сили тяжіння (або вспливання, наприклад, краплі в емульсії – зворотна седиментація).
· Оптичні властивості:




 Ефект Тиндаля (перевірка на колоїдність)
Ефект Тиндаля (перевірка на колоїдність)
 джерело світла конус, що світиться
джерело світла конус, що світиться
· Електричні властивості:
Досліди Рейса
Дослід 1Дослід 2

 + – + – + –
+ – + – + –
 | |||||||
 |  |  | |||||


 |  | ||||
 | |||||


 |


 | |||||
 | |||||
 | |||||

 - -- -
- -- -
 - - - - -
- - - - -

 - - - - - -
- - - - - -
вода кварцовий пісок розчин глини
|
|






