
Схематичне зображення
Фазово-контрастна мікросокпія
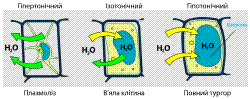
Залежність тургору рослинної клітини від концентрації розчину, в якому вона перебуває
У живих організмах
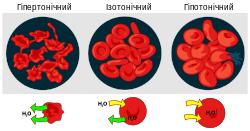
Осмос — це явище, що суттєво впливає на існування живих клітин. Клітинні мембрани більш проникні для води ніж для більшості іонів, малих гідрофільних молекул та макромолекул. Така різниця великою мірою виникає внаслідок наявності в мембранах білків аквапоринів, що пропускають тільки молекули води. Якщо клітина перебуває в ізотонічному розчині (0,9%хлориду натрію або 5% глюкози для людських клітин), вона не втрачає і не набуває води. У гіперотонічому середовищі, тобто у середовищі з більшою осмолярністю, клітина зморщується внаслідок зневоднення, а в гіпотонічому навпаки — набухає, і якщо надходження води не вдається спинити, це призводить до розривання, осмотичного лізису, клітини.
У природних умовах клітини переважно стикаються із проблемою перебування в гіпотонічних розчинах. Щоб запобігти осмотичному лізису вони виробили ряд пристосувань. Наприклад бактерійні, грибні і рослинні клітини мають жорстку клітинну стінку, яка може перешкоджати надмірному надходженню води. Рослини використовують осмос для досягнення механічної стійкості і пружності: висока концентрація розчинених речовин у центральних вакуолях призводить до затягування води в клітини, але це має наслідком не набухання, а збільшення тиску мембран на клітинні стінки, тобто виникнення тургору. Внаслідок цього клітини, і ціле тіло рослини, стають твердими і пружними. Зневоднення призводить до в'янення рослин. Рослинні клітини можуть регулювати тургорний тиск шляхом зміни концентрації осмотично активних речовин, таких як сахароза і неорганічні іони, у центральній вакуолі та цитоплазмі. З цим пов'язано багато аспектів життя рослини: закривання-відкривання продихів, створення тиску у ситоподібних трубках флоеми, що необхідний для транспортування продуктів фотосинтезу, фітогормонів та інших речовин, створення кореневого тиску, потрібного для перенесення води та мінеральних речовин, здійснення рухів, таких як відкривання-закривання пелюсток, піднімання-опускання листків тощо[.
Деякі прісноводні найпростіші, які живуть у гіпотонічному розчині, мають спеціальні органели — скоротливі вакуолі, що викачують зайву воду з клітин. Багатоклітинні тварини підтримують осмолярність плазми крові та тканинної рідини такою ж, як у цитоплазми клітин.
Осмотичні властивості розчинів також впливають і на форми запасання енергії живими клітинами. Так вони зберігають вуглеводи у вигляді полісахаридів (крохмалю і глікогену), а не моно- чи олігосахаридів. Оскільки осмос зростає пропорційно до кількості частинок розчиненої речовини, а не до їх маси, 1 г гілкогену, молекули якого містять по 1000 залишків глюкози, збільшуватиме омолярність цитоплазми до такої ж міри, як і 1 мг глюкози.
Осмос також відіграє важливу роль в екології водойм. Якщо концентрація солі та інших речовин у воді піднімається чи падає — мешканці цих вод гинуть через згубну дію осмосу.
У лабораторній практиці
Осмос широко використовують у лабораторній техніці при визначенні молярних характеристик полімерів, концентрування розчинів, дослідженні різноманітних біологічних структур. Осмотичні явища іноді використовуються в промисловості, наприклад при отриманні деяких полімерних матеріалів, очищенні високо-мінералізованою води методом «зворотного» осмосу рідин.
Протоколи виділення клітинних фракцій, збагачених мітохондріями, пластидами або лізосомами, враховують той факт, що ці органели оточені напівпроникними мембранами. Тому фракціонування проводять у буферах із достатньою концентрацією сахарози або іншої інертної речовини для запобігання осмотичному лізису[1].
Діаліз, що базується на осмотичних властивостях розчинів, використовують для очищення високомолекулярних речовин від низькомолекулярних домішок. Для цього розчин макромолекул із домішками поміщають у мішечок із напівпроникного матеріалу, що пропускає тільки маленькі молекули. Цей мішечок занурюють у розчинник і залишають на деякий час, за який низькомолекулярні речовини дифундують у розчинник. Метод діалізу також використовують для вивчення зв'язування макромолекул із маленькими молекулами, наприклад ферментів із інгібіторами, нуклеїнових кислот із антибіотиками тощо.
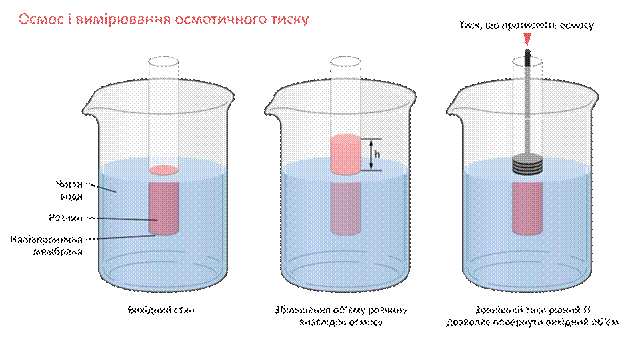
Осмос і вимірювання осмотичного тиску






