 Рис. 135.
Рис. 135.
|
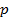 от
от  при заданных
при заданных  , определяемые уравнением Ван–дер–Ваальса для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 135) имеют довольно своеобразный характер. При высоких температурах
, определяемые уравнением Ван–дер–Ваальса для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 135) имеют довольно своеобразный характер. При высоких температурах  изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре
изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре  на изотерме имеется лишь одна точка перегиба
на изотерме имеется лишь одна точка перегиба 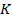 .
.
Эта изотерма называется критической, соответствующая ей температура  – критической температурой; точка перегиба
– критической температурой; точка перегиба 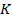 называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем
называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем 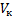 , и давление
, и давление  называются также критическими. Состояние с критическими параметрами
называются также критическими. Состояние с критическими параметрами  называется критическим состоянием. При низких температурах
называется критическим состоянием. При низких температурах 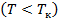 изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
При  стирается различие между жидким и газообразным состоянием вещества, различие в плотности жидкости и пара, обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (рис. 136).
стирается различие между жидким и газообразным состоянием вещества, различие в плотности жидкости и пара, обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (рис. 136).
 Рис. 136.
Рис. 136.
|
 .
.
Уравнение Ван – дер – Ваальса при заданных 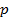 и Т является уравнением третьей степени относительно
и Т является уравнением третьей степени относительно  ; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа
; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа  ,
, 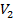 и
и  отвечают (символ «
отвечают (символ « » для простоты опускаем) одному значению давления
» для простоты опускаем) одному значению давления  P 1, второму случаю – изотермы при высоких температурах.
P 1, второму случаю – изотермы при высоких температурах.
 Рис. 137.
Рис. 137.
|
 (рис. 137), видим, что на участках 1 – 3 и 5 – 7 при уменьшении объема
(рис. 137), видим, что на участках 1 – 3 и 5 – 7 при уменьшении объема  давление
давление 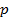 возрастает, что естественно. На участке 3 – 5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3 – 5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7 – 6 – 2 – 1. Часть 6 – 7 отвечает газообразному состоянию, а часть 2 – 1 – жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 – 2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
возрастает, что естественно. На участке 3 – 5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3 – 5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7 – 6 – 2 – 1. Часть 6 – 7 отвечает газообразному состоянию, а часть 2 – 1 – жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 – 2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
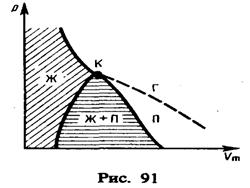 Рис. 138.
Рис. 138.
|
 ,
,  под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа – область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа – область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван–дер–Ваальса с изотермой Эндрюса (верхняя кривая на рис. 138), видим, что последняя имеет прямолинейный участок 2 – 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван -дер-ваальсовой изотермы 5– 6 и 2 – 3. Эти неустойчивые состояния называются метастабильными [51]. Участок 2 – 3 изображает перегретую жидкость, 5 – 6 – пересыщенный пар. Обе фазы ограниченно устойчивы.
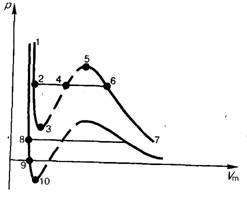 Рис. 139.
Рис. 139.
|
При достаточно низких температурах изотерма пересекает ось
 , переходя в область отрицательных давлений (нижняя кривая на рис. 139). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8 – 9 на нижней изотерме соответствует перегретой жидкости, участок 9 – 10 – растянутой жидкости.
, переходя в область отрицательных давлений (нижняя кривая на рис. 139). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8 – 9 на нижней изотерме соответствует перегретой жидкости, участок 9 – 10 – растянутой жидкости.
Эффект Джоуля – Томсона
Наличие потенциальной энергии взаимодействия молекул проявляется в эффекте Джоуля – Томсона: изменение температуры реального газа при изменении его объёма без теплообмена и без совершения внешней работы.
Если температура  газа понижается
газа понижается  , то эффект считается положительным; если газ нагревается
, то эффект считается положительным; если газ нагревается  , то эффект считается отрицательным. Если при расширении не нагревается и не охлаждается, то эффект Джоуля – Томсона равен нулю. Такое состояние отображается точкой инверсии. Точка инверсии определяет температуру, вблизи которой эффект меняет свой знак.
, то эффект считается отрицательным. Если при расширении не нагревается и не охлаждается, то эффект Джоуля – Томсона равен нулю. Такое состояние отображается точкой инверсии. Точка инверсии определяет температуру, вблизи которой эффект меняет свой знак.
Положительный эффект Джоуля – Томсона используется при получении низких температур.
Глубокого охлаждения газов достигают двумя путями:
1). Температура газа понижается при его расширении вследствие совершения работы против сил сцепления молекул;
2). Температура газа понижается при адиабатном расширении вследствие совершения работы против внешних сил.
Применение первого способа возможно при охлаждении газа ниже температуры инверсии и ниже критической температуры. В настоящее время подвергнуты сжижению и отвердеванию все газы, включая гелий, критическая температура которого  .
.






