Взаимодействие молекул в газе, молекулы которого находятся на относительно большом расстоянии друг от друга, носит характер столкновений. От частоты столкновений зависит время протекания процессов, ведущих к установлению состояния термодинамического равновесия: диффузии, теплопроводности, электропроводности. Кроме того, от частоты соударений зависит протекание фазовых переходов в таких системах.
В действительности молекулы газа, непрерывно соударяясь друг с другом, имеют конечные размеры. Между двумя последовательными соударениями молекулы, двигаясь прямолинейно и равномерно, проходят некоторые расстояния, называемы длинами свободных пробегов. Эти расстояния могут быть самыми различными. Поэтому вводится понятие о средней длине свободного пробега.
Средняя длина свободного пробега – путь, который в среднем проходят молекулы между двумя последовательными соударениями:
 ,
,
 Рис. 116.
Рис. 116.
|
где
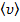 - средняя скорость молекул;
- средняя скорость молекул;  - среднее число столкновений, испытываемых одной молекулой за секунду;
- среднее число столкновений, испытываемых одной молекулой за секунду; 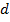 - эффективный диаметрмолекулы, т.е. минимальное расстояние, на которое сближаются при столкновении центры двух молекул ( задаётся в таблицах) (см. рис. 116).
- эффективный диаметрмолекулы, т.е. минимальное расстояние, на которое сближаются при столкновении центры двух молекул ( задаётся в таблицах) (см. рис. 116).
Так как  , то есть
, то есть 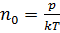 ,то
,то 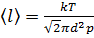 .
.
Таким образом, при заданной температуре средняя длина свободного пробега обратно пропорциональна давлению 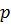 :
:
 .
.
Пример. При эффективном диаметре молекулы  , давлении
, давлении  , температуре
, температуре  ,и средней длине свободного пробега
,и средней длине свободного пробега  , с учетом того, что при этих условиях средняя скорость молекул
, с учетом того, что при этих условиях средняя скорость молекул  , число столкновений молекулы в секунду:
, число столкновений молекулы в секунду:  .
.
Упрощённое доказательство
 Рис. 117.
Рис. 117.
|
Для определения частоты столкновений
 считаем, что молекула имеет форму шара, и движется среди других неподвижных молекул. Эта молекула сталкивается только с теми молекулами, центры которых находятся на расстояниях
считаем, что молекула имеет форму шара, и движется среди других неподвижных молекул. Эта молекула сталкивается только с теми молекулами, центры которых находятся на расстояниях  , то есть лежат внутри «ломаного» цилиндра радиусом
, то есть лежат внутри «ломаного» цилиндра радиусом 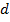 (рис. 117).
(рис. 117).Среднее число столкновений за 1 секунду равно числу молекул в объёме «ломаного» цилиндра:
 ,
,
где  - концентрация молекул, а
- концентрация молекул, а  где
где 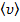 - средняя скорость молекулы, или путь, пройдённый ею за 1 секунду. Таким образом, среднее число столкновений:
- средняя скорость молекулы, или путь, пройдённый ею за 1 секунду. Таким образом, среднее число столкновений:
 .
.
С учетом движения других молекул:  .
.
Тогда средняя длина свободного пробега:  ,то есть
,то есть  обратно пропорциональна концентрации
обратно пропорциональна концентрации  молекул:
молекул:  . С другой стороны давление
. С другой стороны давление 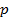 газа прямо пропорционально концентрации
газа прямо пропорционально концентрации  молекул
молекул  , тогда
, тогда  . Следовательно,
. Следовательно,
 .
.
Термодинамика
Термодинамика – часть физики, в которой изучаются наиболее общие закономерности преобразования энергии.
2.1.Термодинамический метод
Термодинамика изучает макроскопические процессы в телах, не рассматривая внутреннее строение тел. Её выводы основаны на общих принципах (началах), являющихся обобщением опытных фактов. В этом смысле – термодинамика – феноменологическая теория.
Классическая термодинамика изучает равновесные состояния и квазистатические процессы. Такие состояния и процессы в реальности не существуют.
2.2. Внутренняя энергия
Внутренняя энергия  (Дж) – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.п.) и энергия взаимодействия этих частиц.
(Дж) – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.п.) и энергия взаимодействия этих частиц.
В общем случае внутренняя энергия термодинамической системы включает следующие компоненты:
1) Кинетическая энергия теплового поступательного и вращательного движения молекул;
2) Кинетическая и потенциальная энергия колебаний атомов в молекулах;
3) Потенциальная энергия, обусловленная межмолекулярными взаимодействиями;
4) Энергия электронных оболочек атомов и ионов;
5) Кинетическая и потенциальная энергия взаимодействия нуклонов в ядрах атомов.
В нашем курсе рассматриваем первый и третий компоненты.
Внутренняя энергия – однозначная функция состояния термодинамической системы, т.е. в каждом состоянии система обладает определённой внутренней энергией (она не зависит от того, как система пришла в данное состояние). При переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода:  .
.
Внутренняя энергия идеального газа
Так как в идеальном газе потенциальная энергия связи между молекулами пренебрежительно мала по сравнению с кинетической энергией их движения, то, исходя из закона равномерного распределения молекул, получим:  , где
, где 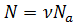 – число молекул газа;
– число молекул газа;  – кинетическая энергия теплового хаотического поступательного и вращательного движения молекул. С учётом этого получаем:
– кинетическая энергия теплового хаотического поступательного и вращательного движения молекул. С учётом этого получаем:  . Так как
. Так как  – универсальная газовая постоянная, то окончательно получим выражение для внутренней энергии идеального газа:
– универсальная газовая постоянная, то окончательно получим выражение для внутренней энергии идеального газа:
 .
.
В случае одного моля идеального газа (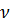 = 1 моль):
= 1 моль):  .
.
Внутренняя энергия моля идеального газа зависит только от его абсолютной температуры.






