Крохмаль – головний резервний полісахарид рослин. Відкладається у клітинах у вигляді зерен, до складу яких входить невелика кількість білків і ліпідів. Накопичується у насінні злакових, картоплі, коренеплодах та ін.
Крохмаль являє собою суміш двох полісахаридів: лінійного – амілози і розгалуженого – амілопектину, загальна формула яких: (C6H10O5)n. Як правило, вміст амілози в крохмалі складає 10–30%, а амілопектину 70–90%.
Полісахариди крохмалю побудовані з залишків a-глюкози, з'єднаних в амілозі та у лінійних ланцюгах амілопектину a-1,4-глюкозидними зв'язками, а в точках розгалуження – міжланцюговими a-1,6-глюкозидними зв'язками.
В амілозі зв'язано в середньому близько 1000 залишків глюкози; окремі лінійні ділянки молекули амілопектину складаються з 20–30 таких одиниць.
При частковому кислотному гідролізі крохмалю утворюються полісахариди меншого ступеню полімеризації – декстрини, при повному гідролізі – глюкоза.
Реактиви: 1. 1,12%-й розчин соляної кислоти; 2. 10%-й розчин таніну; 3. 25%-й розчин оцтовокислого свинцю; 4. 25%-й розчин соляної кислоти; 5. Насичений розчин сірчанокислого натрію.
Принцип методу грунтується на гідролізі крохмалю розбавленою соляною кислотою, осадженні білкових речовин і визначенні кута обертання поляризованого світла за допомогою поляриметра.
Хід роботи. 5 г досліджуваного продукту (подрібненої картопляної кашки тощо) переносять в мірну колбу на 100 мл і додають 50 мл соляної кислоти з концентрацією 1,125%. Колбу ставлять у киплячу водяну баню на 15 хв., перші 3 хв. вміст колби перемішують. Потім колбу виймають, додають в неї воду до загального об’єму 60–90 мл і охолоджують до 20 °С.
Для осадження білків і освітлення розчину в нього додають 0,5–1,0 мл 25%-го розчину оцтовокислого свинцю. Після осадження білків розчин в колбі доводять водою до риски, ретельно перемішують і фільтрують через складчастий фільтр. Перші порції фільтрату виливають. Фільтрат поляризують в поляриметричній трубці довжиною 200 мм. Одержані з допомогою поляриметра значення перемножують на коефіцієнт 1,78 або на коефіцієнт 5,1 при поляризації з круговою шкалою. Одержане значення – це і є вміст крохмалю в досліджуваному продукті (у %).
Досліджувані продукти часто крім крохмалю містять ще й розчинні оптично активні вуглеводи. Значна їх кількість міститься в мерзлій картоплі, лежалих продуктах рослинного походження, картоплі, ураженій хворобами. При аналізі таких продуктів вносять поправку на розчинні вуглеводи.
10 г подрібненого продукту вносять у мірну колбу на 100 мл, приливають 75 мл води і при частому перемішуванні витримують 30 хв., потім додають 5 мл 10%-го розчину таніну. Вміст колби перемішують, після чого додають 5 мл оцтовокислого свинцю і доводять до риски насиченим розчином сірчанокислого натрію. Потім вміст колби ретельно збовтують і фільтрують, 50 мл фільтрату переносять в мірну колбу на 100 мл, додають 2,5 мл 25%-ї соляної кислоти і ставлять у кип’ячу водяну баню на 15 хв. Після цього колбу охолоджують, додають 0,6–2,0 мл 25%-го розчину оцтовокислого свинцю, доводять водою до риски, збовтують і фільтрують. Фільтрат поляризують в поляризаційній трубці довжиною 200 мл. Одержаний результат віднімають від показання поляриметра при першому визначенні і різницю перемножують на коефіцієнт Еверса для картопляного крохмалю.
Приклад 1.
Взято 5 г наважки в колбі на 100 мл. При поляризації в сахариметрі (трубка довжиною 200 мм) знайдено кут обертання площини поляризації 10,5°.
Вміст крохмалю в наважці, %
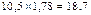 (формула 1)
(формула 1)
Якщо умови визначення були іншими (наважка, вміст колби, довжина трубки), то результат відповідно перераховують. Наприклад, для дослідження взято 20 г наважки, колба на 100 мл, поляризація фільтрату проводилась у трубці довжиною 100 мм.
Поправка на довжину трубки: 200/100=2
Результат за формулою 1 треба збільшити в 2 рази.
Поправка на наважку 20: 5= 4.
Результат за формулою 1 зменшити у 4 рази.
Загальна поправка = 2. Загальний результат зменшити у 2 рази.
Приклад 2.
Наважка – 5 г, трубка довжиною 200 мм. При першому визначенні кут поляризації дорівнює +5,2°, При виявленні поправки (наважка 10 г, трубка довжиною 200 мм) знайдено кут, який дорівнює +0,3°.
Таким чином, вміст крохмалю в досліджуваному продукті дорівнює:
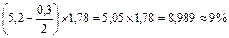
Визначення йодного числа.
Йодне число – кількість грамів йоду, потрібного для насичення ненасичених жирних кислот, що містяться в 100 г жиру. Дає уявлення про ступінь ненасиченості жиру, про здатність до висихання, прогіркання та інші зміни, що відбуваються при зберіганні та переробці жирів. Чим більше у жирі ненасичених жирних кислот, тим вище йодне число. Зменшення йодного числа є показником псування жиру.
Апаратура: аналітичні ваги, водяна баня.
Лабораторний посуд: колби конічні, бюретки для титрування, піпетки, циліндри мірні, мірні колби, медичні склянки з-під пеніциліну.
Матеріали та реактиви: 1. 96%-й етиловий спирт; 2. 0,2 н. розчин йоду в спирті (25,4 г йоду переносять в мірну колбу на 1000 мл і розчиняють в 96%-му етиловому спирті); 3. 0,1 н. розчин тіосульфату натрію; 4. 0,5%–й розчин крохмалю.
Принцип методу полягає в тому, що ненасичені жирні кислоти приєднують галогени за місцем подвійних зв’язків.
Механізм реакції взаємодії ненасичених жирних кислот з йодом:
 |
Йод, що не прореагував, відтитровують 0,1 н. розчином тіосульфату натрію:
J2 + 2Na2S2O3 ® 2NaJ + Na2S4O6
Хід роботи. В суху конічну колбу на 250 мл вносять наважку жиру, який досліджують. Наважку беруть таким чином: на аналітичних вагах зважують медичну склянку з-під пеніциліну, в яку налито масло, відміряють 3–4 краплини рослинного масла у конічну колбу, знову зважують склянку і за різницею мас визначають наважку масла. В колбу доливають 25 мл спирту для розчинення наважки. Якщо масло погано розчиняється, колбу підігрівають на водяній бані. Паралельно проводять контрольний дослід з 25 мл спирту.
В обидві колби додають по 12,5 мл 0,2 н. спиртового розчину йоду, перемішують, приливають по 100 мл дистильованої води, інтенсивно струшують, попередньо закривши пробкою. Через 5 хв. вміст колби титрують 0,1 н. розчином тіосульфату натрію, спочатку до появи слабо-жовтого забарвлення, а потім, після додавання 1 мл розчину крохмалю, титрують до зникнення синього забарвлення.
Різниця між кількістю 0,1 н. розчину тіосульфату, використаного для титрування контрольної і дослідної проб, є показником кількості йоду, зв’язаного наважкою жиру.
Йодне число (ЙЧ) обчислюють за формулою:
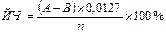
де А і В – кількість 0,1 н. розчину тіосульфату натрію, витраченого відповідно на титрування контрольної і дослідної проб, мл; 0,0127 – кількість грамів йоду, еквівалентна 1 мл 0,1 н. розчину тіосульфату натрію; n – наважка жиру, г; 100 – коефіцієнт перерахунку у відсотки.






