Область науки, изучающей отношение между теплотой и работой, получила название термодинамики. Термодинамика изучает законы превращения энергии, законы перехода одного вида энергии в другой. Превращения энергии подчиняются первому, второму и третьему началам (законам) термодинамики. Причем, если первое начало формирует законы взаимного перехода, то второе и третье определяет направленность превращения энергии.
Первое начало термодинамики представляет собой всеобщий закон природы – закон сохранения энергии, открытый М.В. Ломоносовым в 1758 году. Затем он нашел свое развитие в трудах таких ученых как Г.И. Гесс, Д.Джоуль, Р. Майер, Г. Гельмгольц. Наиболее общей формулировкой закона сохранения энергии является следующая:
Общая сумма энергии материальной системы остается постоянной независимо от изменений, происходящих в ней.
Математически этот закон выражается уравнением:
å Е = const,
где Е – энергия, å - сумма, const – сокращенное constans – постоянный, неизменный.
Из этого закона следует, что энергия данной системы не исчезает и не появляется вновь, а только переходит из одной формы в другую в строго эквивалентных количествах. Это иесть современная формулировка первого начала термодинамики.
Первое начало термодинамики устанавливает связь между количеством энергии, полученной или выделенной системой в каком-либо процессе в виде теплоты Q, количеством произведенной или полученной работы W и изменением внутренней энергии системы DU:
DU = W ± Q,
Внутренняя энергия (U) является полной энергией системы и представляет собой сумму потенциальной и кинетической энергий всех составляющих частей системы (молекул, атомов, ионов и пр.) за исключением потенциальной и кинетической энергии самой системы, как материального тела. Данное уравнение является математическим выражением первого начала термодинамики.
Если процесс изохорный, т.е. если он совершается при постоянном объеме (V = const), то работа не совершается, поскольку при V = const, DV = 0 и, следовательно:
W = -P DV = 0
Знак минус в этом уравнении указывает на то, что система работает против сил внешней среды. В этом случае:
DU = Qn ,
где Qv - количество энергии (Дж/моль или кал/моль), выделенной или поглощенной системой в виде теплоты в ходе процесса при постоянном объеме. Теплота процесса равна изменению внутренней энергии системы и зависит только от конечного и начального состояния системы, т.е.
U2 – U1 = DU = Qn
В реальной жизни часто встречаются изобарные процессы, протекающие при постоянном давлении (Р = const), например, химические реакции, идущие при атмосферном давлении. Изменение внутренней энергии системы в этом случае будет равно
DU = U2 – U1 = W + Qp
где Qp - количество энергии (Дж/моль или кал/моль), выделенной или поглощенной системой в виде теплоты в ходе процесса при постоянном давлении. Поскольку в ходе процессов, идущих при Р = const объем системы изменяется, то работа в таких процессах будет равна величине
W = -P (V2 - V1)
Отсюда:
U2 – U1 = Qp – P(V2 - V1).
В результате тепловой эффект процесса, протекающего при Р = const будет равен Qp = U2 – U1 + P× (V2 - V1)
Qp = (U2 + P×V2) – (U1 + P×V1).
Величина (U + P×V) обозначается буквой Н и называется энтальпией. Энтальпия, также как внутренняя энергия, является функцией состояния, т.е. изменение энтальпии (DН = H2 – Н1) при переходе системы из состояния 1 в состояние 2 при постоянном давлении не зависит от пути перехода, а зависит только от величин энтальпии в конечном (2) и начальном (1) состояниях. Таким образом, тепловой эффект процесса, идущего при постоянном давлении будет равен:
Qp = H2 – Н1 = DН
Следует отметить, что физико-химический смысл функций “внутренняя энергия” и “энтальпия” одинаков. Термин “внутренняя энергия” используется для энергетической характеристики процессов, идущих при V = const, а “энтальпия” – для процессов, идущих при P = const. При этом для конденсированных систем DН = DU, для газов DН ≠ DU.
Первое начало термодинамики дает только энергетическую оценку процессов, протекающих при постоянном объеме или постоянном давлении, но не дает никаких указаний о направлении процесса и предела, до которого изучаемый процесс может идти самопроизвольно. На эти вопросы отвечает второе начало термодинамики посредством новой термодинамической функции, которая называется энтропия и обозначается буквой S.
Наблюдения и опыт показывают, что процессы, происходящие в природе, идут в определенном направлении. Жидкость течет от высокого уровня к низкому, вещество диффундирует из области большей концентрации к меньшей, теплота переходит от тела с более высокой температурой к телу с менее высокой и т.д. Все эти процессы происходят самопроизвольно. Второе начало термодинамики гласит:
Каждая материальная система сама по себе стремится к состоянию термодинамического равновесия.
Таким образом, второй закон термодинамики ограничивает превращение энергии в материальной системе. Клаузиус, подобно Ломоносову, так формулирует второе начало термодинамики: теплота не может сама собой перейти от тела менее нагретому к телу более нагретому.
В современной трактовке второе начало термодинамики звучит таким образом:
Энергия самопроизвольно перемещается от системы с более высоким потенциалом к системе с более низким потенциалом энергии того же вида, до тех пор, пока не наступит термодинамическое равновесие.
Изменение энтропии равно тепловому эффекту процесса, деленному на абсолютную температуру, при которой он происходит, и измеряется в  . Для обратимых изотермических превращений изменение энтропии равно
. Для обратимых изотермических превращений изменение энтропии равно
∆ S = 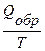 ,
,
где Qобр – часть общего количества энергии, выделенной системой в виде тепла. Таким образом, если DS = 0, то процесс обратимый. Данное уравнение является математическим выражением второго начала термодинамики для обратимых процессов, происходящих в изолированной системе.
Для необратимых химических процессов, протекающих в изолированной системе, второе начало термодинамики имеет следующий вид:
∆ S > 
Таким образом, если в изолированной системе протекает самопроизвольный (необратимый) процесс, то DS > 0.
Процессы, для которых
∆ S < 
самопроизвольно осуществляться в изолированной системе при постоянной температуре не будут. Энтропия как критерий направленности самопроизвольных (необратимых) процессов может быть использована только для характеристики процессов в изолированных системах.
Физический смысл энтропии сводится к характеристике меры хаоса (беспорядка) в системе. Чем больше изменение энтропии в системе, тем меньше полезной работы может совершить данная система.
Изолированная система является идеальным случаем, т.е. такая система не взаимодействует с окружающей средой ни путем обмена энергией, ни путем обмена веществом. Реальные термодинамические системы являются либо закрытыми (могут обмениваться с окружающей средой энергией), либо открытыми (могут обмениваться с окружающей средой и энергией, и веществом). Для указания на направленность самопроизвольного процесса в таких системах используется другая термодинамическая функция - свободная энергия Гиббса (G).
Термодинамическая функция G = H - T×S называется свободной энергией Гиббса, или изобарно-изотермическим потенциалом, или полезной работой. Используется для характеристики системы с точки зрения совершения полезной работы, а также для указания на направленность самопроизвольных процессов, идущих при Р = const и Т = const. В случае самопроизвольных (необратимых) процессов DG < 0, Если в результате процесса DG увеличивается (DG > 0), то такой процесс идет самопроизвольно в обратном направлении. В обратимых процессах в момент достижения равновесия DG = 0.
Термохимия - это раздел термодинамики, в котором изучаются химические реакции с точки зрения их тепловых эффектов. Рассмотрим закрытую термодинамическую систему, в которой происходит химическая реакция
аА + вВ = сС + dD.
В начальном состоянии такая система имеет запас внутренней энергии U1, (а) молей реагента А и (в) молей реагента В. В конечном состоянии, т.е. после прохождения реакции, система будет иметь запас внутренней энергии U2, (с) молей продукта С и (d) молей продукте D. Тепловым эффектом реакции будет называться количество энергии, которая выделяется либо поглощается в форме тепла при взаимодействии реагентов А и В с образованием продуктов С и D с учетом стехиометрических коэффициентов реакции. В зависимости от условий, в которых будет протекать химическая реакция (либо V = const, либо Р = сonst), тепловым эффектом реакции будет либо Qv = DU, либо Qp = DН.
Чтобы сравнить между собой тепловые эффекты разных реакций, необходимо указать точные условия, при которых они протекают. В термодинамике и термохимии за стандартные условия приняты Р = 1 атм и
Т = 298ºК, при этом вещество в этих условиях должно находиться в наиболее устойчивом агрегатном состоянии. Для реакций, проходящих в стандартных условиях, изменение энтальпии обозначается символом DН0298K.
Для реакций, протекающих в газовой фазе, было установлено соотношение между Qp и Qn:
Qp = Qv + Dn×RT.
Это соотношение устанавливает связь между теплотой реакции при постоянном давлении (Qp или DН) и теплотой реакции при постоянном объеме (Qv или DU), является следствием из закона Джоуля. В данном уравнении Dn - разность между числом молей образовавшихся газообразных продуктов и числом молей газообразных реагентов, т.е. Dn = nгазовых продуктов – nгазовых реагентов. Для реакций в конденсированных фазах (твердых и жидких), объем которых в ходе реакции практически не изменяется, т.е. Dn = 0, DН практически не отличается от DU. В этих случаях справедливы равенства
Qp = Qv и DH = DU
Реакции, в результате которых вещество получается из элементов, называются реакциями образования. Изменение энтальпии в ходе таких реакций называется энтальпией образования данного соединения. Не все реакции образования можно реализовать практически. Например, реакция
2С + 3H2 + 1/2O2 = C2H5OH
теоретически является реакцией образования, но практически самопроизвольно не идет. Реакция
С + О2 = СО2
тоже является реакцией образования, но в отличие от первой, она достаточно легко может быть проведена практически.
Стандартной энтальпией образования химического соединения называется изменение энтальпии в ходе реакции образования 1 моль данного соединения из элементов в стандартных условиях и обозначается символом 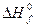 .
.
В ходе реакций образования тепловой эффект представляет собой именно стандартную энтальпию образования соединений, потому что стандартная энтальпия образования самих элементов принята равной нулю (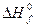 (элементов) = 0).
(элементов) = 0).
Знание стандартных энтальпий образования позволяет рассчитать тепловой эффект любой химической реакции (Qp = DH) не прибегая к экспериментальным измерениям. Из элементов можно: 1) получить непосредственно продукты. Соответствующее изменение энтальпии этой реакции будет равно 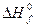 (продуктов). Из элементов можно: 2) получить реагенты. Эта реакция сопровождается изменением энтальпии
(продуктов). Из элементов можно: 2) получить реагенты. Эта реакция сопровождается изменением энтальпии 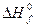 (реагентов). И, наконец, 3) из реагентов можно получить продукты. Изменение энтальпии в ходе этой реакции будет равно DН. Если эти три процесса проходили в стандартных условиях, то термодинамический баланс этих реакций будет равен:
(реагентов). И, наконец, 3) из реагентов можно получить продукты. Изменение энтальпии в ходе этой реакции будет равно DН. Если эти три процесса проходили в стандартных условиях, то термодинамический баланс этих реакций будет равен:
DН0298K = å 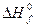 298К (продукты) - å
298К (продукты) - å 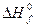 298К (реагенты)
298К (реагенты)
Таким образом, стандартная энтальпия химической реакции равна разности сумм стандартных энтальпий образования всех продуктов и всех реагентов. Так записывается математически закон Гесса.
Если из данных исходных реагентов можно различными путями получить одни и те же конечные продукты, то, независимо от путей получения продуктов, т.е. от вида и количества промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же. Иначе говоря, тепловой эффект химической реакции не зависит от пути перехода "реагенты - продукты", т.е. от промежуточных реакций, а зависит только от вида и состояния продуктов и реагентов. Это положение было постулировано русским ученым Г.И. Гессом в 1840 году и известно как закон Гесса, являющийся основным законом термохимии.
Следствия из закона Гесса:
1. Закон Лавуазье-Лапласа. Тепловой эффект реакции разложения точно равен и противоположен по знаку тепловому эффекту реакции соединения.
Пример:
Са + 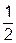 О2 = СаО + 634,71 кДж
О2 = СаО + 634,71 кДж
СаО = Са + 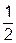 О2 - 634,71 кДж
О2 - 634,71 кДж
Qразл + (-Qсоед ) = 0.
2. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое.
Пример:
С + О2 = СО2 + 409,20 кДж (1)
СО + ½ О2 = СО2 + 284,93 кДж (2)
Вычитая из (1) уравнение (2), можно вычислит тепловой эффект реакции сжигания углерода до окиси углерода:
С + ½ О2 = СО + 124,27 кДж
Таким образом, можно определять тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто и до конца.
3. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое.
Пример:
Суг + О2 = СО2 + 409,20 кДж
Сгр + О2 = СО2 + 393,51 кДж
Таким образом, можно рассчитать тепловой эффект перехода от угля к графиту, который будет равен 409,00 – 393,51=15,69 кДж/моль.






