Комплексонометрическое титрование.
Чаще всего комплексонометрическое титрование применяют для определения ионов металлов с использованием ЭДТА в качестве титранта (например, при определении жесткости воды). Образец воды подщелачивают аммиачным буферным раствором, добавляют индикатор эриохром черный и полученный раствор титруют ЭДТА.
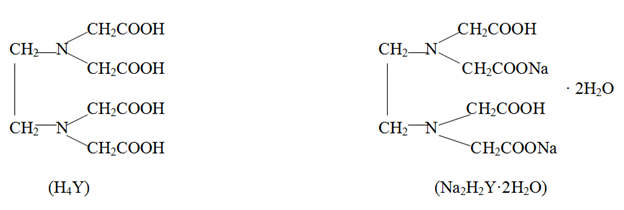
Наиболее распространенными комплексонами являются слабая четырехосновная этилендиаминтетрауксусная кислота (комплексон, ЭДТУК, H4Y) и дигидрат её динатриевой соли (комплексон, ЭДТА, Na2H2Y·2H2O, торговое название «Трилон Б»):
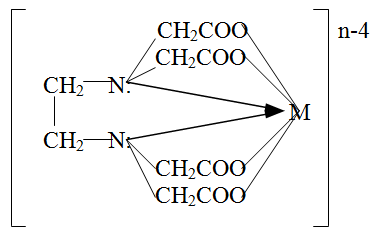
Четырехзарядный анион этилендиаминтетрауксусной кислоты (Y4-) способен образовывать с ионами металлов шесть связей (шестидентатный лиганд), две из которых за счет атомов азота и четыре – за счет ацетатных групп. С двух-, трех- и четырехзаряженными ионами металлов анион Y4- образует тетраэдрические (Ca2+, Mg2+, Ba2+) и октаэдрические комплексы (комплексонаты) состава MYn-4, где n – заряд иона металла.
В комплексонометрическом титровании для определения конечной точки титрования (КТТ) используют специальные металлохромные индикаторы (металлоиндикаторы), образующие с ионами металла менее прочные, чем титрант, комплексы, цвет которых отличается от цвета свободного индикатора. Металлоиндикаторы представляют собой органические вещества (красители), образующие с ионами металлов окрашенные комплексные соединения, менее устойчивые по сравнению с их комплексонатами. Образующиеся комплексы отличаются по цвету от свободных ионов или молекул индикатора.
Общая жесткость воды (Жобщ) преимущественно обу-словлена наличием в ней суммарных концентраций катионов Са2+ (кальциевая ЖCa) и Mg2+ (магниевая ЖMg). Она складывается из карбонатной (временной, устранимой) и некарбонатной (постоянной) жесткости воды. Первая вызвана присутствием в воде гидрокарбонатов Ca и Mg, вторая — наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. При наличии в воде тяжелых металлов они титруются ЭДТА совместно с кальцием и магнием: поэтому перед титрованием их маскируют триэтаноламином или осаждают сульфидом натрия, а также диэтилдитиокарбаминатом натрия. В качестве индикатора используют эриохром черный Т.
Жесткость воды колеблется в широких пределах: от 0,1–0,2 ммоль/л в реках и озерах, расположенных в зонах тайги и тундры, до 80–130 ммоль/л и более в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль/л), средней жесткости (2–10 ммоль/л) и жесткую (более 10 ммоль/л). В поверхностных водах, где преобладает, как правило, карбонатная жесткость (70–80% от общей), наибольшего значения жесткость воды достигает в конце зимы, наименьшего – в период паводка.
 , где 100 – это объем воды, взятый для анализа.
, где 100 – это объем воды, взятый для анализа.






