6.Термоелектронна емісія.
7.Вакуумні прилади.
8.Електропровідність провідників, діелектриків, напівпровідників.
9.Електричний струм у напівпровідниках. Власна та домішкова провідності напівпровідників.
10.Залежність провідності напівпровідників від температури і освітленості.
11.Електронно-дірковий перехід.
12.Напівпровідниковий діод. Напівпровідникові прилади та їх застосування.
1.Електричний струм у рідинах. Електролітична дисоціація. 2.Електропровідність рідин.
3.Явище електролізу. Закони Фарадея.
Електроліти – це речовини, електричний струм у яких завжди супроводжується їх хімічними змінами. Це розчини солей, кислот і лугів у воді. У таких розчинах постійно відбувається розпад молекул на іони. Цей процес називається електролітичною дисоціацією. Внаслідок дисоціації в розчині утворюються позитивні (катіони) іони металів і водню, та негативні (аніони) іони кислотних залишків і гідроксильної групи. У стані динамічної рівноваги розчин характеризується ступенем дисоціації  – відношенням числа n молекул, які дисоціювали на іони, до загального числа n0 молекул речовини:
– відношенням числа n молекул, які дисоціювали на іони, до загального числа n0 молекул речовини: 
Густину електричного струму в електроліті можна визначити за законом Ома:

 – питомий опір електроліту,
– питомий опір електроліту,  – питома провідність електроліту.
– питома провідність електроліту.
При підвищенні температури питомий опір електроліту зменшується, а питома провідність збільшується. Проходження електричного струму через електроліт супроводжується явищем електролізу – виділення на електродах речовин, що входять до складу електроліту. Англійський фізик М. Фарадей в 1833 р установив закони електролізу.
Перший закон електролізу: маса m речовини, яка виділяється на електроді, пропорційна електричному заряду Q, що пройшов через електроліт:

(І=Q/t – сила пропорційного струму, що проходить через розчин за час t).
k – електрохімічний еквівалент речовини, який дорівнює масі речовини, що виділилася на електроді під час проходження через електроліт заряду в 1 Кл.
Другий закон електролізу: електрохімічний еквівалент речовини пропорційний їх хімічному еквіваленту: 
 ,
,
де М – молярна маса, F – стала Фарадея,
F = 96500 Кл/моль.
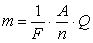 - об’єднаний закон електролізу Фарадея.
- об’єднаний закон електролізу Фарадея.
Електроліз використовують для добування чистих металів, покриття металевим шаром виробів з металів (гальваностегія), електролітичного полірування (гальванопластика).
4.Електричний струм в газах і вакуумі. Несамостійний і самостійний розряди в газах.






