 Схемы гидролиза: 1- гидролиз по катиону – остатку от слабого основания – Кдис < 10-2
Схемы гидролиза: 1- гидролиз по катиону – остатку от слабого основания – Кдис < 10-2
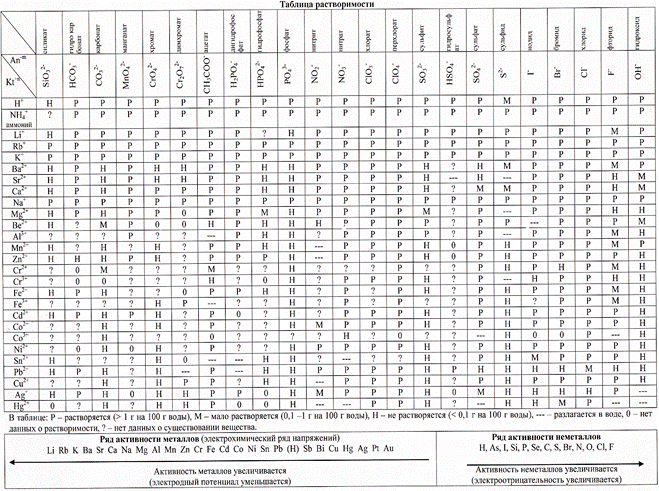
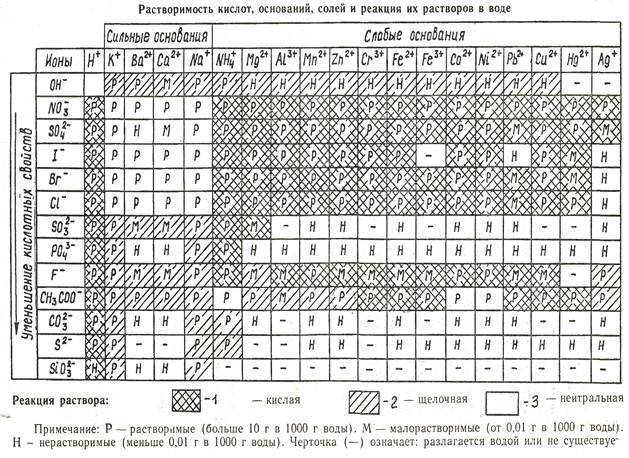
а) MnSO4→ Mn2+ + SO42- Рассмотрим возможности взаимодействия ионов при встрече в
б) HOH ↔ OH- + H+ растворе: SO42- + H+ ↔ HSO41- как остаток от сильной кислоты не может длительно существовать в водном растворе, т.к. под действием полярных молекул воды
и бруновского движения распадается (дисссоциирует) на части. Mn2+ + OH-↔ MnOH1+
MnOH1+ как остаток от слабого основания существует в водном растворе. Равновесие б) нарушается из-за связывания части OH-. По правилу Ле Шателье в системе идут процессы, восстанавливающие равновесие до момента [H+]x[OH-] = 10-14, но при условии [H+] >[OH-] или рН < 7 – кислая среда! Ионное уравнение 1-ой стадии гидролиза записываем из условия: MnSO4 нет в растворе, т.к. все соли, имеющие ионную связь нацело диссоциируют на ионы. Mn2+ + SO42- + HOH ↔ MnOH1+ + H+ + SO42- полное ионное уравнение 1-ой стадии: 2MnSO4 + 2НОН ↔ (MnOH1+)2 SO42- + Н2SO4,
образуется основная соль слабого 2-у кислотного основания сульфат гидроксо Mg или, менее информативно, гидроксосульфата Mg.
Из сокращенного ионного уравнения 1-й стадии можно записать выражение Кравн, которая м.б. названа Кгидр. 1-й стадии.  Принимая во внимание, что вода как очень слабый электролит мало поставляет ионов на реакцию гидролиза и практически её концентрация остается постоянной можем [HOH] ввести в левую часть равенства
Принимая во внимание, что вода как очень слабый электролит мало поставляет ионов на реакцию гидролиза и практически её концентрация остается постоянной можем [HOH] ввести в левую часть равенства
К х[HOH] = Кгидр. 1-йстадии. 
Длиннопериодная форма Периодической табл.


Короткопериодная форма Периодической табл.