Если состав раствора задан в массовых процентах А, то число кг вещества, содержащегося в 100кг растворителя В, находят по формуле:
 (2.1)
(2.1)
Формула
 (2.2)
(2.2)
служит для обратного пересчета.
Когда в растворе присутствует несколько веществ, то вместо величин А и В в формулы (2.1) и (2.2) подставляют суммы концентраций  и
и  веществ в растворе:
веществ в растворе:
 и
и  (2.3)
(2.3)
В 1м3 раствора с концентрацией А % (масс.) вещества содержится  (2.4)
(2.4)
килограммов этого вещества,(ρ – плотность, кг/м3).
Приводим формулы для пересчета концентрации, выраженной в массовых процентах А в концентрацию:
–мольно-массовую (моляльную) m (Кмоль /100 кг растворителя)
 ; (2.5)
; (2.5)
– мольную n (Кмоль /1000 Кмоль растворителя)
 ; (2.6)
; (2.6)
– мольно-объемную с (молярную) (Кмоль/м3 раствора)
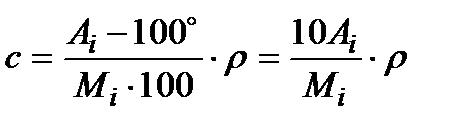 , (2.7)
, (2.7)
где Mi и Mp – молекулярные массы вещества и растворителя.
Для перехода от выражения концентрации в единицах моляльности m к единицам нормальности Сэ (кг, экв./м3 раствора) пользуются формулой:
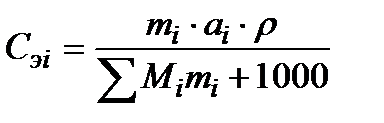 , (2.8)
, (2.8)
где ai – число эквивалентов в одной молекуле.
Концентрацию растворенного вещества, выраженную в единицах нормальности (кг-экв./1м3 раствора, Сэ) можно пересчитать в мольно-процентную концентрацию (кмоль/1000 кмоль раствора, N) по соотношению:
 (2.9)
(2.9)
Пересчет состава многокомпонентного водного раствора, выраженного в кг- экв. ионов на концентрацию, выраженную в кг- экв. отдельных солей, производят при допущении, что в растворе действительно присутствуют те или иные соли. Между солями в четвертной водной взаимной системе существует равновесие:
АМ + BN ↔ AN+BM
отсюда: [A] + [B] = [M] + [N], где [A], [B], [M] и [N]- концентрации ионов.
Состав раствора в г- экв. солей может быть представлен следующими четырьмя вариантами:
[AМ] = [M]; [BN] = [N] и [AN] = [A] – [M] = [N] – [B];
[AМ] = [А]; [BN] = [В] и [ВМ] = [В] – [N] = [M] – [A];
[AN] = [N]; [BM] = [B] и [AМ] = [A] – [N] = [M] – [B];
[AN] = [А]; [BM] = [M] и [ВN] = [В] – [M] = [N] – [A];
В зависимости от соотношения ионов обычно только две из этих физических комбинаций приводят к решению, соответствующему физическому смыслу задачи. Таким образом, формулы перехода от одних выражений концентраций в растворах к другим можно представить в следующем виде:
 (2.10)
(2.10)
 (2.11)
(2.11)
 (2.12)
(2.12)
 (2.13)
(2.13)
 (2.14)
(2.14)
 (2.15)
(2.15)
где А – количество растворенного вещества (в г.) в 100г растворителя, вес %;
В – количество растворенного вещества на 100г растворителя, г;
С – количество растворенного вещества в 1 дм3 раствора, г/л;
Э – число г. экв. растворенного вещества в 1 дм3 раствора;
М – число молей растворенного вещества в 1 дм3 раствора;
M – число молей растворенного вещества на 1000г растворителя;
Экв. вес – эквивалентный вес растворенного вещества;
Мол. вес – молекулярный вес растворенного вещества;
ρ – плотность раствора;
NA, NP, MA, MB – молярные доли и мол. веса компонентов раствора А и В.






