Реактивы:
1) реактив Несслера;
2) 5,0 % раствор сегнетовой соли (KNaC4H4O6·4H2O);
3) стандартный раствор хлористого аммония NH4Cl;
4) дистиллированная вода.
Ход работы. В один колориметрический цилиндр налить 100 мл исследуемой воды, а в другой сначала наливают 1 мл раствора хлористого аммония, а затем доливают до метки 100 мл дистиллированной водой. В оба цилиндра добавляют по 3 мл раствора сегнетовой соли и по 2 мл реактива Несслера. Перемешать. Через 10 минут просматривают цилиндры сверху на белом фоне, сравнивают по интенсивности окраски.
Отливают воду из цилиндра с более интенсивной окраской в измерительный цилиндр или колбу до тех пор, пока будет казаться, что окраска в обоих цилиндрах одинакова. Содержание аммиака в исследуемой воде определяют по формуле:
 ,
,
где  – содержание аммиака в исследуемой воде, мг/л;
– содержание аммиака в исследуемой воде, мг/л;
h1 – высота столба исследуемой воды в цилиндре, см;
С – концентрация стандартного раствора, мг/л;
h2 – высота столба жидкости в цилиндре со стандартным раствором после сравнения окраски, см.
Вопросы к отчету лабораторной работы № 5
1) Пути поступления азотсодержащих соединений в водоемы?
2) Как происходит процесс обезвреживания азота аммонийного в воде водоема?
Лабораторная работа № 6
Определение содержания различных форм углекислоты
Цель работы: изучение методик определения различных форм углекислоты.
Угольная кислота и её соли постоянные компоненты природных вод. Углекислота может находиться в воде в свободной форме и в виде гидрокарбонатов и карбонатов. Содержание свободной угольной кислоты Н2СО3 зависит от концентрации растворенного диоксида углерода. Так как в форме угольной кислоты находится лишь часть растворенного СО2 (около 1 %), то содержание свободной углекислоты в воде характеризуется суммой: Н2СО3 + СО2. При этом расчет ведут не на кислоту, а на СО2. Угольная кислота диссоциирует в водном растворе:
Н2СО3 ↔ Н+ + НСО3-; НСО3- ↔ Н+ + СО32-.
Константы диссоциации для 1 и 2 ступени:
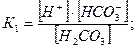


Из уравнений следует, что концентрация свободной угольной кислоты находится в прямой зависимости от концентрации водородных ионов, а концентрация карбонат-ионов – в обратной. При рН < 4,2 в природных водах содержится только свободная угольная кислота. Появление в воде гидрокарбонат-ионов повышает рН от 4,2 до 8,3; в воде присутствует свободная угольная кислота и ионы НСО3-, причем с возрастанием рН увеличивается концентрация НСО3- - ионов и понижается концентрация свободной угольной кислоты. При рН = 8,4 в воде присутствуют практически только гидрокарбонаты (99,7%). При дальнейшем увеличении рН в воде наряду с гидрокарбонат-ионами появляются и карбонат-ионы, которые при рН > 10 становятся преобладающими.
Связанной считается угольная кислота в форме карбонатов, форме гидрокарбонатов она состоит из связанной и полусвязанной кослоты (поровну), так как при кипячении половина гидрокарбонатов переходит в свободную угольную кислоту.
2 НСО3- = СО32- + СО2 + Н2О.
Если в воде находится свободная угольная кислота и НСО3- -ионы, то количество связанной кислоты равно содержанию полусвязанной. При
рН > 8,4 количество связанной кислоты ( ) будет больше полусвязанной (
) будет больше полусвязанной ( ).
).
При одновременном присутствии в воде ионов HCO3- и СО32- определение ведут в одной пробе, нейтрализуя рабочим раствором соляной кислоты щелочность, создаваемую этим ионами. Определение основано на изменении содержания различных форм углекислоты в зависимости от рН. В присутствии кислоты ионы CО32- и НСО3- переходят в свободную угольную кислоту. Карбонаты с соляной кислотой взаимодействуют в две стадии. На первой стадии карбонаты переходят в гидрокарбонаты:

Таким образом, можно считать, что объем кислоты, затраченный на перевод СО32- в НСО3-, соответствует половине содержащихся в воде карбонатов. Индикатор – фенолфталеин.
Проба, оттитрованная рабочим раствором кислоты в присутствии фенолфталеина, содержит гидрокарбонаты, ранее находившиеся в воде, и гидрокарбонаты, образовавшиеся из карбонатов. Гидрокарбонаты переводят в свободную угольную кислоту последующим титрованием пробы кислотой в присутствии метилового оранжевого.
При расчете содержания СО32- -ионов объемов соляной кислоты израсходованной на титрование пробы воды с фенолфталеином, соответственно удваивается. А при расчете количества гидрокарбонатов из объема кислоты, израсходованного на титрование воды в присутствии метилоранжа, вычитается объем, пошедший на титрование с фенолфталеином.
Карбонат – ионы содержатся в щелочных водах. В этом случае, в воде определяют только гидрокарбонаты титрованием кислотой в присутствии метилоранжа.






