Рективы:
1) 0,1 н раствор трилона Б;
2) аммонийно–буферный раствор;
3) индикатор кислотный хром темно–синий.
Ход работы. В коническую колбу отмерить 100 мл исследуемой воды. Добавить 5 мл аммонийной буферной смеси, 5 – 8 капель индикатора кислотного хрома темно–синего и титровать рабочим раствором трилона Б до перехода вишнево–красной окраски в синюю. Раствор трилона Б следует прибавлять по каплям, энергично перемешивая. Расчет жесткости следует производить по формуле:

где Ж о – общая жесткость воды, мг-экв/л;
V1 – объем рабочего раствора трилона Б, пошедшего на титрование пробы воды, мл;
N – нормальность рабочего раствора трилона Б, мг-экв.л;
V2 – объем пробы воды, мл.
3.2 Определение ионов кальция и магния
Реактивы:
1) 0,1 н раствор трилона Б;
2) 2 н раствор NaOH;
3) индикатор мурексид сухой;
4) 5% раствор Na2S;
5) 1% раствор гидроксиламина;
6) индикатор хром темно–синий;
7) аммонийно–буферный раствор.
3.2.1 Определение ионов кальция
Ход работы. К 100 мл исследуемой воды добавляют 5 мл раствора NaOH, несколько (6 – 8) капель Na2S и на кончике лопаточки сухого мурексида. Раствор приобретает темно–розовую окраску. Медленно титруют раствором трилона Б до изменения окраски в винно–красную. Содержание кальция (х) вычисляют по формуле:

где х – содержание кальция в анализируемой воде, мг/л;
a – количество раствора трилона Б, пошедшее на титрование пробы, мл;
 – количество пробы воды, взятое для определения, мл;
– количество пробы воды, взятое для определения, мл;
ЭСа2+ – эквивалент кальция, равный 20.
3.2.1 Определение ионов магния
Ход работы. В пробу после определения ионов кальция добавляют 5 мл аммонийно–буферного раствора, 5 – 6 капель гидроксиламина, 5 – 6 капель индикатора хром темно–синего и медленно титруют 0,1н раствором трилона Б до перехода окраски в синюю. Содержание магния (у) вычисляют по формуле:

где у – концентрация ионов магния в анализируемой пробе, мг/л;
b – количество раствора трилона Б, пошедшее на титрование пробы, мл;
 – количество пробы воды, взятое для определения, мл;
– количество пробы воды, взятое для определения, мл;
ЭМg2+ – эквивалент магния, равный 12.
Вопросы к отчету лабораторной работы №3
1) Какие вещества обуславливают наличие жесткости воды?
2) Виды жесткости?
3) Классы жесткости?
4) Что такое умягчение. Способы умягчения.
5) Последствия использования жесткой воды для удовлетворения хозяйственно-бытовых и промышленных нужд.
6) Реагентные методы умягчения воды.
7) Умягчение воды методом ионного обмена.
8) Термический метод умягчения воды.
Лабораторная работа №4
Определение рН воды
Цель работы: изучить работу рН–метра, ознакомиться с методикой определения рН воды
Степень кислотности и щелочности воды определяется соотношением концентрации водородных– и гидроксид–ионов. Чистая вода – очень слабый электролит (удельная электропроводность при +250С 6,2*10-8 Ом-1* см.-1).

 H2O H++OH-
H2O H++OH-
По закону действия масс, диссоциация воды, как процесс обратимый, характеризуется константой диссоциации
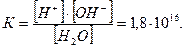
При наличии в воде растворенных солей (при концентрации более 250 мг/л) следует в это выражение подставить активные концентрации (а) ионов H+ и ОH–-:

Концентрацию недиссоциированных молекул Н2О можно принять за постоянную величину, так как при +220С в 1 л из 55,56 молей Н2О диссоциирует только 1*10-7 моля, т.е. чрезвычайно мало. Перенеся [ Н2О ] в левую часть равенства, получим:

Произведение К·[Н2О] при определенной температуре есть величина постоянная. Она называется константой воды (Кв) или ионным произведением воды.
Подставив численные значения К и Н2О, получим:

В чистой воде [Н+]·[ОН-]=1·10-7 (220С).
Таким образом, как бы не менялись концентрации Н+ и ОН–, произведение их всегда будет постоянной величиной. При равенстве концентрации ионов Н+ и ОН– раствор нейтральный. Если концентрация Н+ -ионов больше 1*10-7, то среда кислая. Наоборот, при увеличении концентрации ОН- ионов содержание Н+ становится меньше 1*10-7, раствор щелочной.
Так как между концентрациями Н+ и ОН- - ионов существует обратная зависимость, то реакция среды характеризуется обычно концентрацией Н+- ионов. Чтобы не оперировать с дробными числами, вместо концентрации Н+- ионов пользуются ее отрицательным логарифмом – водородным показателем рН:

Отсюда, растворы с рН = 7 имеют нейтральную реакцию, при рН > 7 – щелочную и при рН < 7 - кислую. рН – важный показатель при химическом анализе воды. Для характеристики природных и сточных вод не меньшее значение имеет гидроксидный показатель рОН:
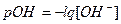 .
.
а) Колориметрический метод определения рН.
Метод основан на изменении окраски индикаторов в зависимости от концентрации ионов водорода. Использующиеся при этом индикаторы – слабые кислоты, у которых окраска недиссоциированных молекул иная, чем анионов, образующихся при диссоциации.
При значительной концентрации Н+ -ионов в растворе диссоциация слабой кислоты уменьшается (действие одноименного иона), и окраску раствору придают молекулы индикатора. В щелочной среде – при незначительной концентрации Н+ -ионов степень диссоциации слабой кислоты увеличивается, и окраску раствору придают анионы индикатора.
Окраска индикатора меняется в определенном интервале рН. Подобрав индикаторы, можно получить шкалу для измерения рН из растворов с заранее известным рН. Прибавляя определенное количество индикатора к исследуемому раствору и сравнивая полученную окраску с эталонными растворами, можно определить рН с точностью до 0,1.
рН колориметрическим методом измеряют, сравнивая окраску исследуемого раствора в присутствии индикатора с окраской растворов в эталонных ампулах шкалы.
Приближенно значение рН определяется с помощью универсальной индикаторной бумаги, которая изменяет окраску в зависимости от концентрации ионов водорода. При значительной мутности воды колориметрический метод неприменим.
б) Потенциометрический метод определения рН.
Активную концентрацию ионов водорода и рН точно определяют потенциометрически. В основу метода положено измерение электродвижущей силы (э.д.с.) концентрационной цепи, состоящей из двух электродов. Потенциал любого электрода можно вычислить по формуле Нернста, зная величину стандартного электродного потенциала Е0 и концентрацию ионов в растворе (активность):
 ,
,
где R – газовая постоянная, 8,313 Дж.град-1.моль-1;
Т – абсолютная температура, 0К,
F – число Фарадея, 96494 К.
Э.д.с. гальванического элемента равна:
 .
.
Подставив вместо Е1 и Е2 их значения и пользуясь вышеприведенной формулой, для ионов с одинаковой степенью окисления (n1=n2) получим:
 .
.
В качестве электрода с нулевым потенциалом условно применяют водородный электрод (платиновая пластинка, покрытая слоем губчатой платины и насыщенная водородом при 101,325 кПа и 200С).
Стандартный электродный потенциал отрицательный (Е0 < 0), если в присутствии водорода на нем происходит окислением, и положительный (Е0>0), когда на нем происходит восстановление.
В практике водородный электрод сравнения часто заменяют простым в обращении хлорсеребряным, имеющим устойчивый потенциал.
рН определяют со следующими парами электродов: хлорсеребряный и стеклянный; хлорсеребряный и платиновый.
Потенциал стеклянного электрода находится в линейной зависимости от рН при значительном изменении концентрации Н+ - ионов,
 ,
,
где Е0 ст.эл. – нормальный потенциал стеклянного электрода, В;
аН – активность

где f - коэффициент активности;
С – концентрация ионов водорода. Тогда

Зная, что 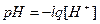 получим:
получим:
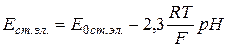
Точно определить Ест.эл. на практике не удается, так как при этом получаются меньшие значения, подверженные колебаниям в зависимости от сорта стекла, температуры, состава электрода. Поэтому перед определением рН исследуемого раствора, стеклянный электрод калибруют по буферным растворам с известным рН.
При определении рН используются потенциометры различных типов. Наиболее распространен сейчас в лабораторной практике универсальный рН–метр рН 410.
4.1. Определение рН воды.
Приборы, реактивы
1) рН – метр лабораторный.
Ход работы. В химический стакан емкостью 100 мл отмерить 50 мл исследуемой воды. В стакан опустить электроды и провести определение рН исследуемой воды. По полученным результатам сделать вывод о среде исследуемых растворов.
Вопросы к отчету лабораторной работы № 4
1) Что такое рН воды? Чем обеспечивается? Величина рН природных вод.
2) Колориметрический метод определения рН воды.
3) Метод буферного определения рН.
4) Потенциометрический метод определения рН воды.
5) Безиндикаторные методы определения рН. Потенциометрическое титрование.
6) Безиндикаторные методы определения рН. Кондуктрометрическое титрование.
7) Что такое буферные растворы и каковы их свойства?
8) В чем состоит значение рН как важного технологического показателя контроля водоподготовки?
Лабораторная работа №5
Определение нитритов и аммиака в воде
Цель работы: изучить методики определениянитритов и аммиака в воде.
Азот в природных водах содержится в виде органических и неорганических соединений. Неорганические формы азота находятся в растворенном состоянии и могут переходить друг в друга.
Главный источник азота в природных водах – белковые соединения растительного и животного происхождения. Образующиеся в результате биохимического расщепления белков, аминокислоты распадаются, выделяя аммиак.
Процесс биохимического окисления аммиака до нитратов называется нитрификацией. Нитрификация протекает в две стадии. Вначале аммиак окисляется до нитритов:
2NH3 + 3О2 = 2HNO2 + 2H2O
Затем, при избытке кислорода нитриты переходят в нитраты:
2HNO2+O2 = 2HNO3
Для хозяйственно – питьевых нужд используют воду, почти не содержащую аммонийного и нитритного азота. Не желательно повышенное содержание и нитратов.






