К III аналитической группе относятся катионы щелочно-земельных металлов: Ba2+, Sr2+, Ca2+. Групповой реагент – раствор серной кислоты, осаждающий сульфаты, растворимость которых уменьшается с увеличением атомной массы элементов.
Фосфаты, оксалаты, силикаты, хроматы, карбонаты катионов Ba2+, Sr2+, Ca2+ также малорастворимы.
Хлориды, нитраты, ацетаты хорошо растворимы в воде.
Общие реакции катионов Ba2+, Sr2+, Ca2+
1. Реакция с серной кислотой.
Серная кислота и растворимые в воде сульфаты образуют с ионами Ba2+, Sr2+, Ca2+ белые кристаллические осадки по уравнению:
Me2+ + SO42– = MeSO4↓.
Все осадки не растворимы в кислотах и щелочах, но имеют различную растворимость в воде:
 ,
,  ,
,  .
.
Наименее растворим BaSO4, CaSO4 – значительно растворяется в воде. Поэтому осадок ВаSO4 определяется моментально даже из разбавленных растворов, SrSO4 – через некоторое время, СаSO4 – только из достаточно концентрированных растворов. Следует отметить, что растворимость CaSO4 понижается при добавлении спирта или ацетона. В отличие от ВаSO4 и SrSO4 растворимость сульфата кальция в значительной степени повышается в присутствии сульфата аммония за счёт образования нестойкой соли:
CaSO4 + (NH4)2SO4 = (NH4)2[Ca(SO4)2].
Для перевода МеSO4 в раствор, их превращают в МеСО3, которые легко растворяются в кислоте:
↓MeSO4 + CO32– = ↓MeCO3 + SO42–.
Практически это превращение осуществляется путём многократной обработки осадка сульфатов насыщенным раствором Na2CO3 при нагревании (мокрый способ) или сплавлением его в тигле с 5-6-кратным избытком смеси Na2CO3 и К2CO3 (сухой способ).
В ы п о л н е н и е р е а к ц и и. К растворам солей Ba2+, Sr2+, Ca2+ добавить 1,5-кратный избыток раствора Н2SO4. Выпадают белые кристаллические осадки. Обратить внимание и отметить скорость образования и количество осадка. Если осадок CaSO4 не выпадает, потереть палочкой о стенки пробирки. Отобрать раствор над осадком CaSO4 в другую пробирку, добавить спирт или ацетон. Что происходит? Почему?
2. Реакция с гипсовой водой.
Гипсовая вода, то есть водный насыщенный раствор гипса CaSO4·2Н2О образует с ионами Ba2+ и Sr2+ белые кристаллические осадки. Ион бария образует осадок сразу, осаждение SrSO4 происходит не- полностью, очень медленно, нагревание раствора ускоряет образование осадка. Это объясняется различной растворимостью сульфатов: в насыщенном растворе CaSO4 равновесная концентрация SO42– равна 3·10-3. Это количество вполне достаточно для осаждения ВаSO4, например, из 1·10–3 М раствора соли. Для SrSO4 при этой же концентрации Sr2+
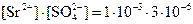 ,
,
что немного больше 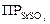 и недостаточно для полного осаждения катионов стронция.
и недостаточно для полного осаждения катионов стронция.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям раствора солей Ba2+, Sr2+ и Ca2+ в пробирках добавить насыщенный раствор гипсовой воды. Описать в тетради наблюдаемые явления. Пробирку с SrSO4 нагреть 2-3 мин. На водяной бане. Что происходит?
3. Реакция с бихроматом и хроматом калия.
K2CrO4 и K2Cr2O7 образуют с катионами Ba2+ и Sr2+ жёлтые кристаллические осадки хроматов состава MeCrO4:
Me2+ + CrO42– = ↓MeCrO4;
2Me2+ + Cr2O72– + H2O = 2MeCrO4↓ + 2H2+.
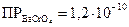 ,
,  , ПРSrCrO4=2,24.10-5
, ПРSrCrO4=2,24.10-5
Катионы кальция осаждаются только из концентрированных растворов, вследствие высокой растворимости СаCrO4. При рН < 7 катионы стронция и кальция не осаждаются.
Образование хроматов при действии К2Cr2O7 объясняется, во-первых, присутствием в растворе К2Cr2O7 ионов CrO42– согласно равновесию:
Cr2O72– + Н2О D 2 CrO42– + 2Н+.
Во-вторых, меньшей растворимостью МеCrO4 по сравнению с МеCr2O7. Полное осаждение Ва2+ происходит при рН~5, поэтому в реакционную смесь добавляют избыток СН3СООNa, создавая ацетатную буферную смесь:
СН3СОО2– + Н+ D СН3СООН.
Этим пользуются для отделения Ba2+ от Sr2+ и Ca2+, не дающих осадков в данных условиях.
В ы п о л н е н и е р е а к ц и и. К растворам Ba2+, Sr2+ и Ca2+ добавить избыток К2CrO4. Отметить наблюдаемые явления. Проверить действие HCl и CH3COOH. Провести аналогичный опыт с К2Cr2O7. Сопоставить результаты.
4. Реакция с оксалатом аммония.
(NH4)2C2O4 образует с катионами III группы белые кристаллические осадки оксалатов:
Ме2+ + С2О42– = ↓МеС2О4.
Осадки растворимы в минеральных кислотах. Наиболее полно осаждается оксалат кальция, менее – оксалат бария:
 ,
, 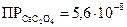 ,
,  .
.
В уксусной кислоте осадок CaС2О4 практически нерастворим, а осадки ВаС2О4 и SrC2O4 заметно растворимы, особенно при нагревании.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям растворов солей Ba2+, Sr2+, Ca2+, добавить небольшой избыток раствора (NH4)2C2O4. разделить полученные осадки на 2 части и проверить растворимость: а) в растворе HCl; б) в растворе СН3СООН. Записать наблюдаемые явления.
5. Реакция с карбонатом аммония.
(NH4)2СО3 осаждает катионы Ba2+, Sr2+, Ca2+ в виде белых осадков, малорастворимых в воде:
Ме2+ + СО32– = ↓МеСО3.
 ,
,  ,
,  .
.
Эти осадки легко растворяются в уксусной и минеральных кислотах с выделением углекислого газа.
В ы п о л н е н и е р е а к ц и и. К растворам солей Ba2+, Sr2+, Ca2+ добавить раствор (NH4)2СО3, испытать растворимость осадков в растворе HCl и СН3СООН.
6. Окрашивание пламени.
Летучие соли бария окрашивают пламя горелки в желтовато-зелёный цвет, стронция – в карминно-красный, кальция – в кирпично-красный цвет.
В ы п о л н е н и е р е а к ц и и. В 3 фарфоровые лодочки налить по 1 мл спирта, аккуратно поджечь и внести шпательками сухие соли (хлориды, нитраты) Ba2+, Sr2+, Ca2+, наблюдать за окраской пламени.
Частные реакции иона Ва2+
Специфических реакций на катион Ba2+ нет, некоторые из общих являются характерными в определённых условиях.
1. Реакция с бихроматом калия
При рН 4-5, т.е. в ацетатном буфере, ион Ba2+ даёт кристаллический осадок, растворимый в сильных кислотах. Ионы Sr2+ и Ca2+ в данных условиях не осаждаются. Мешают ионы Pb2+. Выпадению осадка способствует нагревание.
В ы п о л н е н и е р е а к ц и и. В пробирку с несколькими каплями раствора хлорида или нитрата бария добавить по несколько капель СН3СООNa и K2Cr2O7. Наблюдать образование осадка. Записать уравнение реакции.
Частные реакции иона Sr2+
Ион Sr2+ также не имеет специфических реакций.
1. Осаждение гипсовой водой.
В отсутствии ионов Ba2+ и Pb2+ для открытия стронция используется его осаждение насыщенным раствором гипсовой воды CaSO4·2H2O.
В ы п о л н е н и е р е а к ц и и. В пробирку с несколькими каплями раствора соли стронция добавить несколько капель насыщенного раствора CaSO4·2H2O. Подогреть на водяной бане 5 минут. Через 10-15 минут наблюдать образование необильного белого осадка. Записать уравнение реакции.
Частные реакции иона Са2+
Для открытия Ca2+ используют следующие реакции.
1. Микрокристалоскопическая реакция с серной кислотой.
При действии серной кислоты на соли кальция выпадают кристаллы гипса CaSO4·2H2O, различимые под микроскопом в виде характерных пучков игл. Для получения хороших кристаллов целесообразно вести осаждение из сравнительно разбавленных растворов.
В ы п о л н е н и е р е а к ц и и. На предметное стекло поместить каплю раствора соли кальция, добавить каплю 2N раствора Н2SO4, слегка упарить смесь до появления каёмки по краям капли и рассмотреть образовавшиеся кристаллы под микроскопом. Зарисовать их форму.
В присутствии Ba2+ и Sr2+ можно поступить следующим образом: осадить ионы Ba2+, Sr2+ и частично Ca2+ действием 1,5-ного избытка 2N раствора Н2SO4, нагревать 5-6 минут на водяной бане, отфильтровать. Каплю фильтрата, содержащего некоторое количество ионов Ca2+ и SO42–, поместить на предметное стекло упарить и рассмотреть полученные кристаллы под микроскопом. Сравнить кристаллы по форме с полученными в предыдущем опыте.
2. Реакция с гексацианоферратом (II) калия.
K4[Fe(CN)6] даёт возможность обнаружить Ca2+ в присутствии Sr2+. Взаимодействие идёт по уравнению:
Ca2+ + 2NH4+ + [Fe(CN)6]4– = ↓Ca(NH4)2[Fe(CN)6]
и сопровождается осаждением белого кристаллического осадка, нерастворимого в уксусной кислоте, в отличие от Sr2+. Реакцию ведут при рН~9, в присутствии аммонийной буферной смеси.
В ы п о л н е н и е р е а к ц и и. К нескольким каплям раствора соли кальция добавить по 2 капли растворов NН4Cl и NH3 и равный объём K4[Fe(CN)6]. Смесь перемешать и нагреть на водяной бане 2-3 минуты. Что образуется? Проверить растворимость осадка в уксусной кислоте. Сделать вывод. Ион Ва2+ при значительной концентрации может также дать осадок с K4[Fe(CN)6]. Поэтому в присутствии Ва2+ применять эту реакцию для обнаружения Са2+ не следует.
Ход анализа смеси катионов III группы
Отделение Ba2+, Sr2+ и Ca2+ основано на различной растворимости хроматов и сульфатов этих катионов.
Условия осаждения и разделения ионов Ba2+ и Sr2+.
При действии K2Cr2O7 на раствор, содержащий ионы бария, установятся следующие равновесия:
Cr2O72– + H2O D 2CrO42– + 2H+,
HCrO4– + H+ D H2CrO4,
Cr2O72– + H2O D HCrO4–,
Ba2+ + CrO42– D BaCrO4.
Из приведённых уравнений следует, что в результате периодических реакций в растворе возможно существование различных хромсодержащих форм: H2CrO4, HCrO4–, CrO42–,– концентрация которых будет определяться [H+] в растворе.
Ион считается полностью осаждённым, если его концентрация в растворе остаётся 1·10–6 моль/л, поэтому для полного осаждения BaCrO4 необходима [CrO42–], равная:
 .
.
Доля свободных хромат-ионов (α2) в растворе определяется уравнением:
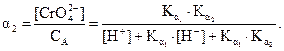
Решим это уравнение относительно [Н+], подставив полученную величину [CrO42–], CА = 0,1М и  ,
,  .
.
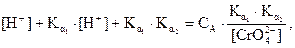

 моль/л.
моль/л.
При этом рН происходит полное осаждение хромата бария. Поскольку осаждение хромата бария ведут обычно в ацетатном буферном растворе при рН~5, путём обратных расчётов при [H+], равной 10–5, получаем α2 = 3,1·10-2.
 моль/л.
моль/л.
 моль/л
моль/л
Действительно, в ацетатном буфере хромат бария будет осаждаться полностью. Выпадет ли в этих условиях SrCrO4?
 г-ион/л,
г-ион/л,
т.е. ионы стронция практически останутся в растворе и в ацетатном буфере возможно разделение Ва2+ и Sr2+ в виде хроматов.
В ы п о л н е н и е а н а л и з а
1. Открытие и отделение катионов бария.
К 1,5 мл смеси добавить избыток раствора бихромата калия при рН~4-5 (регулируется с помощью ацетата натрия). Образование жёлтого осадка хромата бария укажет на наличие катионов бария в растворе. Отфильтровать осадок и проверить фильтрат на полноту осаждения ионов бария. После полного удаления Ва2+ фильтрат анализируют на Sr2+, Ca2+.
2. Осаждение Sr2+ и Ca2+ в виде карбонатов.
К полученному фильтрату добавить насыщенный раствор Na2CO3 до щелочной реакции. Осадок карбоната отфильтровать, промыть водой и растворить, обрабатывая осадок на фильтре раствором уксусной кислоты.
3. Открытие Sr2+.
В части уксуснокислого раствора определить содержание Sr2+ реакцией с гипсовой водой при нагревании на водяной бане.
4. Разделение Sr2+ и Ca2+.
Если в растворе есть ионы Sr2+, то их нужно удалить перед определением Ca2+. Для этого к оставшемуся уксуснокислому раствору добавить (NH4)2SO4: ионы стронция в виде сульфата осаждаются, ионы кальция остаются в растворе в виде комплексной соли. Отфильтровать.
5. Открытие Са2+.
Фильтрат разделить на две части: к одной добавить оксалат аммония, ко второй – ацетон или спирт. Выпадение осадков укажет на присутствие катионов Са2+.
6. Сделать вывод о катионном составе исходной смеси и занести результаты в таблицу.






