Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Значение потенциала зависит от концентрации соответствующих ионов в растворе. Например, потенциал серебряного электрода, погруженного в раствор соли серебра, изменяется с изменением концентрации Аg+ в растворе. Поэтому, измерив потенциал электрода, погруженного в раствор данной соли неизвестной концентрации, можно определить содержание соответствующих ионов в растворе.
Электрод, по потенциалу которого судят о концентрации определяемых ионов в растворе, называют индикаторным электродом.
Потенциал индикаторного электрода определяют, сравнивая его с потенциалом другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применен такой электрод, потенциал которого остается неизменным при изменении концентрации определяемых ионов. Обычно в качестве электрода сравнения применяют нормальный водородный электрод.
Потенциал нормального водородного электрода условно приравнивают нулю, поэтому э. д. с. (Ех) гальванического элемента, составленного из индикаторного электрода и нормального водородного электрода сравнения, приравнивают к потенциалу индикаторного электрода:
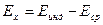 (1)
(1)
Если Еср=0
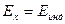
 (2)
(2)
На практике часто в качестве электрода сравнения с известным значением электродного потенциала пользуются не водородным, а каломельным электродом:
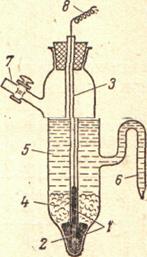
Каломельный электрод: 1 – слой ртути; 2 - платиновая проволока; 3 - стеклянная трубка; 4 - паста из каломели; 5 -насыщенный раствор КС1  ; 6 - сифон; 7 - боковая трубка; 8 - медная проволока для включения электрода в цепь.
; 6 - сифон; 7 - боковая трубка; 8 - медная проволока для включения электрода в цепь.
Потенциал каломельного электрода во время работы практически не изменяется. Зависимость потенциала каломельного электрода (по сравнению с потенциалом нормального водородного электрода) от условий анализа приведена в таблице:
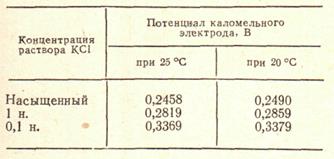 Потенциал каломельного электрода (по отношению к нормальному водородному электроду)
Потенциал каломельного электрода (по отношению к нормальному водородному электроду)
Электрод, потенциал которого хотят измерить (например, серебряный), соединяют с электродом сравнения (каломельным, водородным и т. д.) и получившуюся ячейку включают в схему, измеряющую напряжение (потенциометр, ламповый вольтметр). Во время измерения напряжения поддерживают достаточно низкой силу тока (от 10-6 до 10-14 А), проходящего через ячейку. При малой силе тока характеристики ячейки не изменяются.
Потенциал электрода является функцией активности веществ. Например, потенциал серебряного электрода в растворе ионов серебра выражают уравнением
Е = Е° + 0,059 1g aAg+
где Е° = 0,7995 В — нормальный потенциал для процесса, выражаемого уравнением
Аg+ + е- 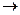 Аg
Аg
Следовательно, активность ионов серебра (равно как и активность других ионов) можно определять по потенциалу Е. Для определения концентрации ионов серебра (СAg+) необходимо знать коэффициент активности (fAg+):
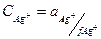
Определение точки эквивалентности по потенциалу индикаторного электрода. Зависимость потенциала индикаторного электрода от концентрации раствора может быть использована для определения точки эквивалентности при титровании. В точке эквивалентности, когда концентрация определяемого иона сильно уменьшается и становится практически ничтожной, происходит резкое изменение потенциала, регистрируемое чувствительным потенциометром.
Например, если в раствор, содержащий Аg+, опустить серебряный индикаторный электрод и электрод сравнения, то серебряный электрод приобретает положительный заряд. При титровании раствора, содержащего Аg+, раствором NаС1 концентрация ионов серебра уменьшается и потенциал индикаторного электрода изменяется. Потенциал же электрода сравнения является постоянным. Поэтому во время титрования по мере взаимодействия определяемого вещества (Аg+) со стандартным раствором прибавляемого реактива (NаС1) наблюдается постепенное и нарастающее изменение потенциала индикаторного электрода. Вблизи точки эквивалентности происходит сильное изменение концентрации ионов серебра, сопровождающееся резким изменением потенциала индикаторного электрода, что и является признаком конца титрования.
Титрование, при котором точка эквивалентности определяется по скачку потенциала электрода, погруженного в раствор, называют потенциометрическим титрованием. Потенциометрическое титрование применяют при методах нейтрализации, оксидиметрии, осаждения, комплексообразования.
Кривые потенциометрического титрования.
Характерная кривая потенциометрического титрования приведена на рисунке, где по оси ординат отложены значения потенциала индикаторного электрода, а по оси абсцисс - объем раствора хлорида, добавляемого к раствору.
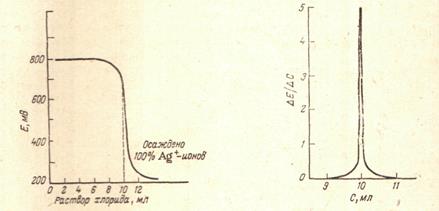
1.Кривая потенциометрического титрования АgNO3 раствором NаС1;
2.Дифференциальная кривая потенциометрического титрования АgNO3 раствором NаС1.
Потенциометрическое титрование может быть с успехом применено не только для титрования растворов, к которым применим индикаторный метод, но и для титрования окрашенных и мутных растворов, когда индикаторные методы титрования применить нельзя. Потенциометрическое титрование широко применяют для определения слабых и очень слабых кислот и оснований, смесей кислот или оснований, смесей окислителей или восстановителей в неводных средах. Наконец, потенциометрический метод применяют для определения рН исследуемых растворов.
Если на оси ординат откладывать не значение потенциала, а отношение 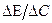 , т. е. величину изменения потенциала при добавлении1 мл раствора хлорида, то получается кривая, на которой еще более отчетливо видно положение точки эквивалетности.
, т. е. величину изменения потенциала при добавлении1 мл раствора хлорида, то получается кривая, на которой еще более отчетливо видно положение точки эквивалетности.
Определение рН.
Потенциал индикаторного электрода функционально связан с концентрацией ионов водорода. Водородный электрод, получаемый погружением платиновой пластинки, покрытой платиновой чернью, в насыщенный газообразным водородом кислый раствор, находится в равновесии с ионами водорода:
К = [Н+]/[Н] или К = аН+/аН
где [Н+] — концентрация ионов водорода в растворе;
[Н] — концентрация водорода в платине при постоянном давлении (величина постоянная),
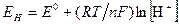 или
или 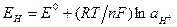 (3)
(3)
Так как потенциал нормального водородного электрода (Е°) равен нулю, то потенциал водородного электрода выражают формулой:
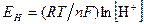 или
или 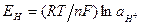 (4)
(4)
или
ЕН = 0,059 1g [Н+] или ЕН = 0,059 1g аН+ (5)
При пользовании каломельным электродом, потенциал которого (Екал) известен, значения Ех исследуемого раствора вычисляют по формуле:
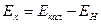 (6)
(6)
или
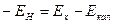 (7)
(7)
Так как ЕН = 0,059 1g [Н+], то
 (8)
(8)
где Еx – э.д.с. исследуемого элемента.
Комплексонометрия
Хотя число различных комплексонов в настоящее время составляет не одну сотню, под термином «комплексонометрия», обычно имеют в виду реакции титрования солями этилендиаминтетрауксусной кислоты, чаще всего раствором ее двухзамещенной натриевой соли Ка2Н2Y*2H2O2 (комплексон III), широко известной под торговым названием трилон Б. Четырехзарядный анион этилендиаминтетрауксусной кислоты принято обозначать Y4- или ЭДТА.
Реакции взаимодействия различных катионов с ЭДТА в растворе протекают по уравнениям:
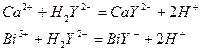
Как видно, независимо от заряда катиона в реакции комплексообразования принимает участие один анион и происходит выделение двух ионов водорода.
Образование в результате реакции титрования только соединения состава 1: 1 (МY) и отсутствие в условиях титрования продуктов ступенчатого комплексообразования являются существенным достоинством комплексонометрии, упрощая, в частности, теоретическое обоснование различных практических методик определения индивидуальных элементов и их смесей без предварительного химического разделения компонентов.
Молярные массы эквивалента титранта и определяемого катиона равны их молярным массам.
Степень протекания реакции зависит от рН раствора. Влияние кислотности раствора особенно заметно при титровании катионов, образующих сравнительно малоустойчивые комплексы (Мg2+, Са2+ и др.): их можно оттитровать лишь в щелочной среде. Многие катионы титруются в аммиачном буферном растворе (Zn2+, Cd2+ и др.). Катионы, образующие очень устойчивые комплексы, как, например, Fе3+, могут быть оттитрованы в довольно кислом растворе.
Рабочие растворы
Основным рабочим раствором комплексонометрии является раствор ЭДТА. Эта соль легко получается в чистом виде, хорошо растворима в воде, растворы устойчивы при хранении. В обычных условиях препарат содержит примерно 0,3% влаги, поэтому титрованные растворы ЭДТА можно готовить по точной навеске (с учетом 0,3% Н20). Однако обычно его титр устанавливают по раствору соли цинка, полученному растворением точной навески металлического цинка в хлороводородной кислоте. Применяемые для титрования растворы ЭДТА имеют концентрацию 0,01—0,05 моль/л и реже 0,1 моль/л.
Установка титра раствора ЭДТА
Для приготовления стандартного (титрованного) раствора ЭДТА применяют двунатриевую соль этилендиаминтетрауксусной кислоты, кристаллизующуюся с двумя молекулами воды; ее состав отвечает формуле 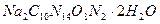 .
.
Если двунатриевую соль, содержащую кристаллизационную воду, высушить при 120—140°С, то получается безводная соль, состав которой соответствует формуле  .
.
Обе соли могут служить исходными веществами для приготовления стандартного раствора ЭДТА.
Для приготовления 1 л 0,1 н. раствора ЭДТА надо взять:
М (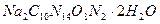 )/2 * 10 = 372,24/2 *10 = 18,61 г
)/2 * 10 = 372,24/2 *10 = 18,61 г
или
М ( )/2*10 = 336,21/2 * 10 = 16,81 г
)/2*10 = 336,21/2 * 10 = 16,81 г
Для установки титра ЭДТА применяют х. ч. карбонат кальция, х. ч. Z пО илих. ч. металлический цинк, рассчитанную навеску которых растворяют в х. ч. хлористоводородной или серной кислоте, нейтрализуют едким натром или аммиаком, разбавляют аммиачным буферным раствором и титруют стандартным раствором ЭДТА в присутствии необходимого индикатора. Под конец титруют медленно.
Титр раствора может быть установлен также по фиксаналу соли магния (имеются 0,01 и 0,05 н. растворы сульфата магния).
По результатам титрования рассчитывают Т, N и К раствора ЭДТА.
Кривые титрования
Как показывают уравнения реакции взаимодействия катионов ЭТДА, при титровании происходит выделение ионов водорода, для связывания которых в анализируемый раствор вводят аммиачный буфер или щелочь.
В результате расчетов мы можем построить кривую титрования, в которой имеется точка эквивалентноси, в которой происходит резкий скачок из-за резкого измениния концентрации ионов никеля (скачок титрования). Этот скачок титрования, как и вся кривая, характеризует изменение условной концентрации ионов никеля Ni2+ в ходе титрования.
Величина скачка титрования зависит от констант устойчивости образующихся комплексов в растворе и концентрации реагентов. Суммарный эффект устойчивости комплексов и концентраций “вспомогательного” лиганда отражается условной константой устойчивости. Чем меньше условая константа устойчевости, тем меньше скачок титрования. Численное значение условной константы устойчивости определяется истинной константой устойчевости комплекса, образующегося при титровании, константами устойчивости с “вспомогательным” лигандом и pH раствора.
Способы фиксирования точки эквивалентности
Определение точки эквивалентности при комплексонометрическом титровании может быть проведено различными способами.
Во-первых, используют обычные кислотно-основные индикаторы, так как реакция комплексообразования сопровождается выделением H+-ионов в количестве, эквивалентном количеству определяемого катиона:
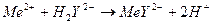
Выделившуюся кислоту определяют методом нейтрализации с обычными кислотно-основными индикаторами.
Во-вторых, применяют металл-индикаторы, представляющие собой органические красители, которые образуют с катионами определяемых элементов растворимые в воде окрашенные комплексные соединения. Получаемые при этом комплексные соединения менее устойчивы, чем внутрикомплексные соли, образуемые определяемыми катионами с комплексонами. Поэтому в процессе титрования комплексоном раствора, содержащего окрашенное комплексное соединение, образуемое определяемыми катионами с индикатором, в точке эквивалентности наблюдается изменение окраски раствора. Это объясняется тем, что комплексное соединение индикатора разрушается и индикатор выделяется в свободном виде. Так как окраска комплексного соединения индикатора отличается от окраски свободного индикатора, то происходит изменение окраски титруемого раствора.
Схематично это можно представить следующим образом;
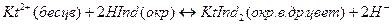
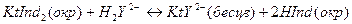
Таким образом, металл-индикатор реагирует на изменение концентрации катиона аналогично тому, как кислотно-основной индикатор ведет себя при изменении рН титруемого раствора.
В-третьих, для фиксирования точки эквивалентности применяют окислительно-восстановительные (ред-окс) индикаторы и инструментальные методы.
Практическое применение
Высокая устойчивость координационных соединений ионов металлов с Y4- - открывает принципиальную возможность титриметрического определения большой группы катионов. В зависимости от устойчевости координационных соединений с титрантом и с индикатором, а также от других особенностей реагирующей системы применяют методы как прямого титрования, так и титрования по остатку и замещению.
В настоящее время комплексонометрические методы разработаны для анализа очень многих объектов. Например, определение жесткости воды, определение Mg2+ и Ca2+ в различных растворах и материалах, комплексонометрический анализ различных сплавов, руд и концентратов, определение сульфата, фосфата и других анионов, анализ органических соединений и др.
Общая оценка метода
Среди титрометрических методов, основанных на реакциях комплексонообразования, наибольшее значение имеют реакции с применением комплексонов. Устойчивые координационные соединения с комплексонами образуют почти все катионы, поэтому методы комплексонометрии универсальны и применимы к анализу широкого круга объектов. Рабочие растворы устойчивы. Для установления точки эквивалентности имеется набор цветных индикаторов и разработаны физико-химические методы индикации. Точность титриметрических определений примерно 0,2…0,3 %. Методы комплексонометрии непренывно усовершенствуются. Синтезируются новые типы комплексов, обладающих повышенной селективностью, и новые индикаторы. Расширяются применения комплексонометрии.
Выполнение работы
Определение меди методом комплексонометрии
1. Реакция титранта с исследуемым веществом.
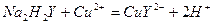
2. Титрант в данной работе – трилон Б – он является первичным, поэтому для приготовления раствора титранта необходимо трилон Б разбавить водой в два раза, для этого мы берем 200мл трилона Б и добавляем к нему 200мл.воды.
3. Стандартизация раствора.
Для того, чтобы стандартизовать раствор, необходимо взять три колбы для титрования и пипеткой на 10мл добавить в каждую раствора MgSO4 с концентрацией 0,025 моль/л, затем также в каждую колбу добавляем по 100 мл воды и 10мл аммиачного буфера (рН=9-10), затем добавляем немного эриохром черного Т; раствор при этом приобретает винно-красную окраску и начинаем титровать приготовленным раствором трилона Б до перехода в зеленую окраску.
4. Работа с бюреткой.
Предварительно бюретку споласкивают водой, затем дистиллированной водой, раствором титранта. Заливают раствор титранта в бюретку и заполняют носик так, чтобы в носике не осталось воздуха. Начинаем титровать приготовленный раствор в колбе. Перед вторым титрованием объем бюретки доводится до 0.
Закончив титрование, мы можем определить концентрацию трилона Б, по полученным объемам.
V1=9,9 мл
V2=10,2 мл
V3=9,9 мл
Находим средний объем Vср=10 мл
Стр. Б=(СMgSO4*VMgSO4)/ Vср=(0,025*10)/10=0,025 моль/л.
5. Выполнение задачи.
Задачу доводим до метки водой и тщательно перемешиваем. Затем пипеткой отбираем в три колбы для титрования по 10 мл раствора задачи, добавляем по 100 мл воды, 10 мл аммиачного буфера (рН=8,4) и индикатор – мурексид. Растворы в колбах приобретают желтый цвет. Титруем готовые растворы приготовленным ранее трилоном Б до появления фиолетовой окраски.
Получим три объема:
V1=9,3 мл
V2=9,6 мл
V3=9,6 мл
Найдем средний объем: Vср=9,5 мл
Найдем массу меди, содержащуюся в растворе:
mCu=Cтр.Б*MCuSO4*10-3*Vср*a, где а=200/10=20
mCu=0,025*160*9,5*20*10-3=0,76 г
Определение серной кислоты методом потенциометрии
1. Приготовление раствора титранта:
NaOH – вторичный титрант.
Готовим 400 мл 2,5М раствора из 0,1М.
N1V1=N2V2; V2=N1V1/N2=0,1*400/2,5=16мл; VH2O=400-16=384мл
В колбу для приготовления титранта маленьким цилиндром отмеряем 16 мл NaOH и большим цилиндром 384 мл воды. Раствор тщательно перемешиваем и заливаем в бюретку.
2. Стандартизация раствора титранта:
Берем навеску янтарной кислоты. N(янт. к-ты)=0,1моль/л; V=250мл; М=118
m=N*V*Э=0,1*0,25*59=1,475
Навеску количественно переносим в мерную колбу на 250 мл. Кристаллы растворяем в половинном объеме раствора кислоты. После этого доводим объем до метки водой и тщательно перемешиваем.
N(янт. к-ты)=m(общ.)-m(стакан.)/Э*V=9,1824-7,7074/59*0,25=0,1моль/л
В 3 колбы для титрования пипеткой отмеряем по 25 мл стандартного раствора янтарной кислоты, 50 мл воды и 5 капель фенолфталеина и титруем до появления устойчивой нежно-розовой окраски.
V=26,8 мл
V=27,3 мл Vср=27 мл
V=27 мл
N(NaOH)=N(янт.к-ты)*V(янт.к-ты)/V(NaOH)=0,1*0,25/0,27=0,0926моль/л
4. Исследуемый раствор доводим до метки водой и тщательно перемешиваем.
В стакан электрохимической ячейки отбираем 25 мл раствора и 50 мл воды. Опускаем электроды, включаем магнитную мешалку и начинаем измерения, добавляя в раствор по 0,5 мл раствора титранта.
| V,мл | pH |
| 1,8 | |
| 0,5 | 1,83 |
| 1,85 | |
| 1,5 | 1,87 |
| 1,88 | |
| 2,5 | 1,91 |
| 1,92 | |
| 3,5 | 1,94 |
| 1,97 | |
| 4,5 | 1,99 |
| 2,01 | |
| 5,5 | 2,04 |
| 2,07 | |
| 6,5 | 2,09 |
| 2,12 | |
| 7,5 | 2,15 |
| 2,18 | |
| 8,5 | 2,21 |
| 2,24 | |
| 9,5 | 2,28 |
| 2,32 |
| 10,5 | 2,36 |
| 2,39 | |
| 11,5 | 2,44 |
| 2,49 | |
| 12,5 | 2,55 |
| 2,63 | |
| 13,5 | 2,71 |
| 2,78 | |
| 14,5 | 2,89 |
| 3,01 | |
| 15,5 | 3,23 |
| 3,62 | |
| 16,5 | 4,46 |
| 5,17 | |
| 17,5 | 5,37 |
| 5,44 | |
| 18,5 | 5,46 |
| 5,50 | |
| 19,5 | 5,51 |
| 5,53 |
По полученным данным определяем скачок титрования. Это область от 15 до 17 мл.
Проводим новые измерения, но в области скачка титруем по 0,1 мл.
| V,мл | pH | 
|
| 1,85 | ||
| 0,5 | 1,85 | |
| 1,85 | ||
| 1,5 | 1,87 | 0,04 |
| 1,89 | 0,04 | |
| 2,5 | 1,91 | 0,04 |
| 1,93 | 0,04 | |
| 3,5 | 1,95 | 0,04 |
| 1,97 | 0,04 | |
| 4,5 | 2,00 | 0,06 |
| 2,02 | 0,04 | |
| 5,5 | 2,04 | 0,04 |
| 2,07 | 0,06 | |
| 6,5 | 2,10 | 0,06 |
| 2,13 | 0,06 | |
| 7,5 | 2,16 | 0,06 |
| 2,19 | 0,06 | |
| 8,5 | 2,22 | 0,06 |
| 2,26 | 0,08 | |
| 9,5 | 2,29 | 0,06 |
| 2,33 | 0,08 | |
| 10,5 | 2,37 | 0,08 |
| 2,42 | 0,1 | |
| 11,5 | 2,47 | 0,1 |
| 2,51 | 0,08 | |
| 12,5 | 2,60 | 0,18 |
| 2,67 | 0,14 | |
| 13,5 | 2,73 | 0,12 |
| 2,84 | 0,22 | |
| 14,5 | 2,94 | 0,2 |
| 3,13 | 0,38 | |
| 15,1 | 3,15 | 0,2 |
| 15,2 | 3,19 | 0,4 |
| 15,3 | 3,25 | 0,6 |
| 15,4 | 3,31 | 0,6 |
| 15,5 | 3,37 | 0,6 |
| 15,6 | 3,46 | 0,9 |
| 15,7 | 3,53 | 0,7 |
| 15,8 | 3,63 | |
| 15,9 | 3,74 | 1,1 |
| 3,98 | 2,4 | |
| 16,1 | 4,02 | 0,4 |
| 16,2 | 4,38 | 3,6 |
| 16,3 | 4,59 | 2,1 |
| 16,4 | 4,92 | 3,3 |
| 16.5 | 5,02 | 2,8 |
| 16,6 | 5,20 | 1,8 |
| 16,7 | 5,30 | |
| 16,8 | 5,33 | 0,3 |
| 16,9 | 5,36 | 0,3 |
| 5,37 | 0,1 |
По полученным данным строим график зависимости 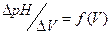 и определяем по нему V титранта.
и определяем по нему V титранта.
m(H2SO4)=N(NaOH)*V*Э(H2SO4)*a*10-3
m=0,0926*16,2*49*20*10-3=1,47 г
Выводы
В результате данной курсовой мы смогли определить содержание меди и серной кислоты в растворах меднения двумя методами: комплексометрии и потенциометрии. Получили следующие результаты: содержание меди – 0,76 г; содержание серной кистоты 1,47 г.
Список использованных источников:
1. В. П. Васильев «Аналитическая химия» ч.1, 2, Издательство «Высшая школа», М., 1989г.
2. А. П. Крешков «Основы аналитической химии» ч.2, Издательство «Химия», М., 1971г.
3. Ю.М. Полежаев «Избранные методы инструментального анализа» Учебное пособие по курсу «Физические методы анализа», Издательство УПИ им. С.М.Кирова, Свердловск, 1981г.
4. Ю.М. Полежаев «Основы титриметрии: Методические указания к лабораторным работам», Свердловск: УПИ, 1989г.






