Свойства серной кислоты
Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества теплоты. Плотность серной кислоты при ОºС равна 1,85 г/см3. Она кипит при 296ºС и замерзает при -10ºС. Серной кислотой называют не только моногидрат, но и водные растворы его (H2SO4 + nH2O), а также растворы серного ангидрида в моногидрате (H2SO4 + nSO3 называемые олеумом). Олеум на воздухе «дымит» вследствие десорбции из него серного ангидрида. Чистая серная кислота бесцветна, техническая окрашена примесями в темный цвет.
Большое значение имеет изменение температуры плавления и температуры кипения ее в зависимости от концентрации. При увеличении концентрации от 0 % до 64,35% серного ангидрида последовательно образуется шесть гидратов, являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде, а образуют эвтектические смеси. В области концентраций серного ангидрида от 64,35 до 100% при кристаллизации образуются твердые растворы. В зимнее время при низких температурах нельзя производить и применять кислоту концентрацией, близкой к чистому серному ангидриду; 2S0з ∙ H2О и S0з ∙ 2H2О так как из этих растворов могут выпадать кристаллы, которые забьют кислотопроводы между цехами, хранилища, насосы и неутепленную аппаратуру. Все товарные сорта серной кислоты имеют концентрации, близкие к эвтектическим смесям.
Смесь, соответствующая 98,3 % серной кислоты, является азеотропной и имеет единую температуру конденсации паров, и кипения жидкости 336,6ºС. При небольшом изменении состава в обе стороны от азеотропной точки температура начала конденсации пара, называемая точкой росы, сильно отличается от температуры начала кипения жидкого раствора. Соответственно отличаются составы жидкой фазы и полученных из нее паров (или наоборот).
Диаграмму кипения системы H2О - SО3 используют для определения режима концентрирования разбавленной серной кислоты при выпаривании из нее воды. Диаграмма показывает, что при нагревании кислоты, содержащей менее 80 % H2SO4, температура кипения лежит ниже 200ºС, при этом в пары переходит почти исключительно вода; лишь при концентрации кислоты свыше 93 % (пунктир на диаграмме) в паровой фазе значительно повышается содержание H2SO4.
Пары серной кислоты при повышении температуры диссоциируют:
H2SO4.= H2О + SОз
и выше 400ºС уже содержат больше молекул серного ангидрида, чем серной кислоты. Дальнейшее нагревание вызывает диссоциацию серного ангидрида:
2SO2 + O2.
Выше 700ºС в парах преобладает сернистый ангидрид, а выше 1000ºС серный ангидрид диссоциирует почти полностью. Степень диссоциации меняется при изменении давления. Такого рода термическая диссоциация характерна для сложных химических соединений.
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Особенно хорошо серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду от других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду как таковую, а водород и кислород в сочетании Н: О = 2. Дерево и другие, растительные и животные ткани, содержащие целлюлозу (C6Н10О5), крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
Свойства меди
Физические свойства меди
| Tплавления | Tкипения | ra | Ρ | Rудельное |
| 1083 0C | 2877 0C | 98 нм | 8,96 г/cм3 | 1,63*10-8 ом*м |
.
Цвет меди и её соединений.
Чистая медь обладает интересной особенностью. Красный цвет обусловлен следами растворенного в ней кислорода. Оказалось, что медь, многократно возогнанная в вакууме (при отсутствии кислорода), имеет желтоватый цвет. Медь в полированном состоянии обладает сильным блеском.
При повышении валентности понижается окраска меди, например CuCl – белый, Cu2O – красный, CuCl + H2O – голубой, CuO – черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем обусловлен интересный практический признак для поисков.
Электропроводимость.
Медь обладает наибольшей (после серебра) электропроводимостью, чем и обусловлено её применение в электронике.
Кристаллическая решетка.
Медь кристаллизируется по типу централизованного куба

Кристаллическая решетка меди.
Химические свойства меди
Отношение к кислороду
Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:

В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
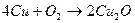
Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.

Рисунок 2. Строение оксидной пленки меди.
Взаимодействие с водой.
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
 .
.
Эта реакция окислительно-восстановительная, так как происходит переход электронов:


Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода.

Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
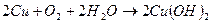

Взаимодействие с кислотами
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
 .
.
Отношение к галогенам и некоторым другим неметаллам.
Qобразования (CuCl) = 134300 кДж
Qобразования (CuCl2) = 111700 кДж

Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты.
Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например:
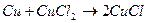 .
.
Монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Оксид меди
При прокаливании меди на воздухе она покрывается черным налетом, состоящим из оксида меди
 .
.
Его также легко можно получить прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO3)2. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород – в воду восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Под слоем меди расположен окисел розового цвета – закись меди Cu2O. Этот же окисел получается при совместном прокаливании эквивалентных количеств меди и окиси меди, взятых в виде порошков:
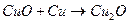 .
.
Закись меди используют при устройстве выпрямителей переменного тока, называемых купроксными. Для их приготовления пластинки меди нагревают до 1020-1050 0C. При этом на поверхности образуется двухслойная окалина, состоящая из закиси меди и окиси меди. Окись меди удаляют, выдерживая пластинки некоторое время в азотной кислоте:
 .
.
Пластинку промывают, высушивают и прокаливают при невысокой температуре – и выпрямитель готов. Электроны могут проходить только от меди через закись меди. В обратном направлении электроны проходить не могут. Это объясняется тем, что закись меди обладает различной проводимостью. В слое закиси меди, который примыкает непосредственно к меди, имеется избыток электронов, и электрический ток проходит за счет электронов, т.е. существует электронная проводимость. В наружном слое закиси меди наблюдается нехватка электронов, что равноценно появлению положительных зарядов. Поэтому, когда к меди подводят положительный плюс источника тока, а к закиси меди – отрицательный, то электроны через систему не проходят. Электроны при таком положении полюсов движутся к положительному электроду, а положительные заряды – к отрицательному. Внутри слоя закиси возникает тончайший слой, лишенный носителей электрического тока, - запирающий слой. Когда же медь подключена к отрицательному полюсу, а закись меди к положительному, то движение электронов и положительных зарядов изменяется на обратное, и через систему проходит электрический ток. Так работает купроксный выпрямитель.
Гидроксиды меди
Гидроксид меди малорастворимое и нестойкое соединение. Получают его при действии щелочи на раствор соли:  . Это ионная реакция и протекает она потому, что образуется плохо диссоциированное соединение, выпадающее в осадок:
. Это ионная реакция и протекает она потому, что образуется плохо диссоциированное соединение, выпадающее в осадок:

Медь, помимо гидроксида меди (II) голубого цвета, дает еще гидроксид меди (I) белого цвета:
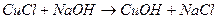 .
.
Это нестойкое соединение, которое легко окисляется до гидроксида меди (II): 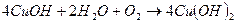 .
.
Оба гидроксида меди обладают амфотерными свойствами. Например, гидроксид меди (II) хорошо растворим не только в кислотах, но и в концентрированных растворах щелочей: 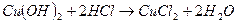 ,
,
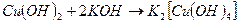 .
.
Таким образом, гидроксид меди (II) может диссоциировать и как основание: 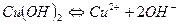
и как кислота. Этот тип диссоциации связан с присоединением меди гидроксильных групп воды:
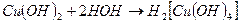
Сульфаты
Наибольшее практическое значение имеет CuSO4*5H2O, называемый медным купоросом. Медный купорос образует прекрасно оформленные кристаллы в форме косых параллелепипедов красивого ярко-синего цвета, хорошо растворимых в воде (14,3 г при 0° С в расчете на безводный сульфат, 20,5 г при 20° С, 75,4 г при 100° С). При хранении в сухой атмосфере или при нагревании до 105° С кристаллы медного купороса теряют две молекулы воды, переходя в синий тригидрат CuSO4·3H2O. При 150о С образуется моногидрат CuSO4·H2O, а полное обезвоживание происходит при 250° С. При этом синяя соль превращается в белый порошок (примеси обычно придают ей серый цвет). Безводная соль и моногидрат жадно притягивают воду и могут служить осушителями.
В результате гидролиза растворы медного купороса имеют кислую реакцию. В щелочных растворах медный купорос образует основные соли, например, CuSO4·3Cu(OH)2·nH2O, где n = 0, 2, 5. При избытке сульфата щелочного металла образуются двойные соли (шёниты) бледного сине-зеленого цвета, которые кристаллизуются из растворов в виде кристаллогидратов состава M2Cu(SO4)2·6H2O, где М = NH4+, K+, Rb+, Cs+. Известны и смешанные сульфаты (двойные купоросы) медного купороса с сульфатом марганца, цинка, кадмия, кобальта, никеля, железа(II). При добавлении даже к сильно разбавленному бледно-голубому раствору медного купороса аммиака раствор приобретает глубокий сине-фиолетовый цвет в результате образования комплексных аммиакатов меди.
В природе медный купорос встречается в виде минерала халькантита; известны также минералы с другим содержанием воды: бонаттит (тригидрат CuSO4·3H2O), бутит (гептагидрат CuSO4·7H2O), халькокианит (безводный сульфат).
Получают медный купорос растворением оксида меди или медных отходов в разбавленной серной кислоте (в последнем случае окислителем меди служит продуваемый через раствор воздух), при обжиге сульфидов меди, как побочный продукт при очистке меди методом электролиза с растворимым медным анодом. Также его готовят растворением меди в концентрированной серной кислоте. Поскольку медь относится к малоактивным металлам и расположена в ряду напряжений после водорода, водород при этом не выделяется:
 .
.
Медный купорос применяют как протраву при крашении тканей, для консервирования древесины, протравливания семян. Известный инсектицид бордосская жидкость представляет собой смесь растворов медного купороса и известкового молока; последний добавляют для нейтрализации раствора, чтобы растения не получили кислотного ожога.
В медицине разбавленный (0,25%-ный) раствор медного купороса применяют как антисептическое и вяжущее средство, 5%-ный раствор – при ожогах белым фосфором, а 0,5%-ный раствор – внутрь при отравлениях белым фосфором. Это применение основано на переводе фосфора в нерастворимый фосфид и частично – в металлическую медь; процесс приблизительно можно передать уравнением
18P + 20CuSO4 + 32H2O = 8H3PO4 + 5Cu + 5Cu3P2 + 20H2SO4.
Малые дозы медного купороса (несколько капель 1%-ного раствора в молоке) назначают иногда при анемии для усиления кроветворения.
Меднение
Меднение - нанесение медных покрытий гальваническим методом на обезжиренные и протравленные стальные или цинковые готовые изделия, иногда на стальную проволоку. Меднение часто применяется для защиты отдельных участков стальных изделий от цементации (науглероживания); при этом меднятся те участки, которые в дальнейшем подлежат обработке резанием (твёрдые науглероженные поверхностные слои не поддаются такой обработке, а медь защищает покрытые участки от диффузии в них углерода). Более распространённая область применения — защитно-декоративное хромирование стальных или цинковых изделий, при котором медь играет роль промежуточного слоя; поверх меди наносится слой никеля, а на него — очень тонкий слой хрома (0,25 мкм). Различают 2 типа медных электролитов: кислые и щелочные. В кислых электролитах нельзя получить прочно сцепленные медные покрытия на стальных и цинковых изделиях, так как в этом случае железо и цинк в контакте с медью растворяются — нарушается сцепление с покрытием. По этой причине необходимо первый тонкий слой меди (2—3 мкм) нанести в щелочном электролите, а в дальнейшем наращивать покрытие в более экономичном кислом электролите до заданной толщины. Цинковые изделия сложной формы меднятся только в щелочных (цианистых) электролитах.
Электролитическое меднение является широко применяемой операцией во всех отраслях машиностроения, приборостроения, в гальваностегии и гальванопластике. Осадки меди в гальванотехнике используют как в форме самостоятельных технологических слоев, так и в составе многослойных покрытий. В производстве печатных плат медные осадки используют в качестве проводящих элементов. Тонкослойные медные покрытия применяют для защиты стальных изделий от цементации, для повышения электропроводности, а также как промежуточный слой на заготовках из стали, цинка, цинковых и алюминиевых сплавов перед нанесением никелевого, хромового, серебряного и других видов покрытия для лучшего сцепления с основой или для повышения защитной способности покрытия.
Толстослойные медные осадки применяют в производстве гальванопластических изделий (с использованием металлических и неметаллических форм - в полиграфии, при изготовлении барельефов, труб, волноводов и т.п.).
В настоящее время для электроосаждения меди разработано большое количество электролитов. В ГОСТ 9.305-84 представлены несколько электролитов электрохимического меднения. Особенно широко используются сернокислые электролиты ввиду дешевизны, доступности и химической стабильности исходных основных компонентов. Введение в эти электролиты добавок и использование нестационарных методов электролиза дают возможность нанесения из сернокислых электролитов качественного, хорошо сцепленного с основой покрытия, значительно интенсифицировать процесс электроосаждения и в широких пределах изменять физико-механические свойства гальванического слоя металла, не прибегая к использованию дефицитных солей. Достаточно широко применяют в производстве также комплексные электролиты, среди которых особенное место принадлежит цианидным электролитам, которые позволяют без осложнений получать хорошо сцепленные с основой покрытия на
деталях из стали, алюминия и других более активных, чем медь металлов. Считается, что наибольший интерес в качестве альтернативы токсичным цианидным электролитам (несмотря на дефицит компонентов) могут представлять пирофосфатные электролиты меднения, что связано с их относительной малотоксичностью, повышенной рассеивающей способностью и возможностью непосредственного (без промежуточных подслоев) меднения сталей.
В литературе можно встретить сведения об электроосаждении меди из электролитов на основе неводных растворителей, но пока не показаны преимущества в свойствах полученных из них осадков. Важно также, что при использовании органических сред проблематична возможность существенной интенсификации процесса электроосаждения и не маловажными в этом случае становятся вопросы стоимости электролитов и безопасности работы с ними.
Для химического меднения плат пpименяется следyющий pаствоp:
Сеpнокислая медь(медный кyпоpос)...2г
Едкий натp.........................4г
Hашатыpный спиpт 25%-ный...........1мл
Глицеpин...........................3,5мл
Фоpмалин 10%.......................8-15мл
Вода...............................100 мл
После осаждения меди платy пpомывают и сyшат. Слой полyчается очень тонким, его толщинy при необходимости можно yвеличить до 50мк гальваническим способом.






