226. Имеется 400 г сплава олова со свинцом, содержащего (по массе) 30% олова и 70% свинца. Какой из этих металлов и в каком количестве находится в сплаве в виде кристаллов, вкрапленных в эвтектику, если последняя содержит 64% (масс.) олова и 36% (масс.) свинца?
227. При сплавлении олова с магнием образуется интерметаллическое соединение Mn2Sn. В какой пропорции нужно сплавить указанные металлы, чтобы полученный сплав содержал 20% (масс.) свободного магния?
228. По диаграмме плавкости системы Сd–Bi (рис.1) определить, какой из металлов и при какой температуре начнет выделяться первым при охлаждении жидких сплавов, содержащих: а) 20% Вi; б) 60% Вi; в) 70% Вi.
229. Какой металл будет выделяться при охлаждении жидкого сплава меди и алюминия, содержащего 25% (масс.) меди, если эвтектика включает 32,5% (масс.) меди? Какую массу этого металла можно выделить из 200 г сплава?





 350 1000
350 1000
 Cd 3210C
Cd 3210C






 300 900
300 900
 2710С
2710С



 250 Bi 800
250 Bi 800



 200 700
200 700
 Mg 6500C
Mg 6500C




 150 600 Sb
150 600 Sb
6300C










 100
100 
0 20 40 60 80 100 0 20 40 60 80 100
Содержание Bi, % (масс.) Содержание Sb, % (масс.)
Рис.1.Диаграмма состояния Рис.2.Диаграмма состояния
системы Cd–Bi системы Mg–Sb
230. Сплав олова со свинцом содержит 73% (масс.) олова. Найти массу эвтектики в 1 кг твердого сплава, если эвтектика включает 64% (масс.) олова?
231. Серебряные монеты обычно чеканят из сплава, состоящего из равных масс меди и серебра. Сколько граммов меди находится в 200 г такого сплава в виде кристаллов, вкрапленных в эвтектику, если последняя содержит 28% (масс.) меди?
232. По диаграмме плавкости системы Mg–Sb (рис.2) установить формулу интерметаллического соединения, образуемого этими металлами. Каков будет состав твердой фазы, которая выделяется первой при охлаждении жидкого сплава, содержащего 60% (масс.) сурьмы? Что будет представлять собой затвердевший сплав?
233. По диаграмме плавкости системы Сu–Mg (рис.3) найти формулы интерметаллических соединений, образуемых этими металлами.
234. Имеется 500 г сплава 72% висмута и 28% кадмия.
Сколько граммов висмута содержится в сплаве в виде вкрапленных в эвтектику кристаллов? Состав эвтектики: Bi 60%, Cd 40%.






 1100
1100
 Сu 10830C 1453 A
Сu 10830C 1453 A

 1000
1000




 900
900









 800 Е
800 Е
D
Mg

 700
700
 6500C
6500C



 600 650 K
600 650 K

 500
500



 16 43
16 43 

 400
400  500
500
0 20 40 60 80 100 Ni 100% Sb 100%
Содержание Mg, % (масс.) Содержание Sb, % (масс.)
Рис.3.Диаграмма состояния Рис.4.Диаграмма состояния
системы Cu–Mg системы Ni–Sb
235. Магний образует с сурьмой химическое соединение, в состав которого входят 23% Mg и 77% Sb. Сколько граммов этого соединения содержится в 1 кг сплава, состав которого Mg 60%, Sb 40%?
236. Сплав имеет состав: Sn 30%, Pb 70%. В 800 г сплава содержится 425 г свинца в виде кристаллов, вкрапленных в эвтектику. Вычислите состав эвтектики.
237. Эвтектика металлов Cu и Ag имеет состав: Cu 29%, Ag 72%. В 1 кг сплава этих металлов содержится 400 г эвтектики. Вычислить состав сплава, если медь содержится в нем в избытке.
238. Свинец и магний образуют химическое соединение, в котором Pb 81%, Mg 19%? Что представляет собой твердый сплав, имеющий состав: Pb 60%, Mg 40%? Какой металл находится в нем в свободном состоянии? Сколько его содержится в 400 г сплава?
239. Что представляет собой сплав, имеющий состав: Pb 85%, Mg 15%. Вычислить массу химического соединения этих металлов (состав см.задачу 238), содержащегося в 300 г сплава.
240. Магний и сурьма образуют соединение состава: Mg 23%, Sb 77%. Что собой представляет затвердевший сплав этих металлов, имеющий состав Mg 30%, Sb 70%. Какой из металлов находится в свободном состоянии? Сколько его содержится в 300 г сплава?
241. Вычертить диаграмму плавкости для сплава свинца с магнием по следующим данным:
| Pb, % | 67,5 | |||||
| Mg, % | 32,5 | |||||
| Т.пл., 0С |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Pb 10% и Mg 90% при 700, 500 и 4000С. Что будет представлять собой затвердевший сплав?
242. Вычертить диаграмму плавкости для сплава образованного магнием и сурьмой, по следующим данным:
| Mg, % | |||||
| Sb, % | |||||
| Т.пл., 0С |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Mg 50% и Sb 50% при 800, 600 и 4000С. Что будет представлять собой твердый сплав?
243. Вычертить диаграмму плавкости для сплава меди с серебром по следующим данным:
| Cu, % | ||||||||
| Ag, % | ||||||||
| Т.пл.,0С |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Cu 55% и Ag 45% при 1000, 800 и 4000С. Что будет представлять собой твердый сплав?
244. Вычертить диаграмму плавкости для сплава, состоящего из олова и свинца по следующим данным:
| Sn, % | ||||||
| Pb, % | ||||||
| Т.пл., 0С |
Пользуясь диаграммой, установить, в каком состоянии будет находиться сплав состава Sn 15% и Pb 85% при 400, 200 и 1500С. Что будет представлять собой затвердевший сплав?
245. По диаграмме плавкости сплава Bi–Pb (рис.6) определите состав жидкой и твердой фаз для системы, содержащей 55% Pb и 45% Bi при 1500С. Какая масса твердой фазы выделится при кристаллизации 300 г этого сплава при данной температуре?
246. Сколькими степенями свободы обладает система, содержащая 40% Cu и 60% Ag при 8000С?. Диаграмма плавкости на рисунке 5.
247. Определите температуру затвердевания и плавления сплава, содержащего 60% Ni и 40% Cu. Диаграмма плавкости на рисунке 7.
248. При какой температуре будет затвердевать и плавиться сплав, содержащий 80% Au и 20% Pt? Определите число степеней свободы для сплава данного состава при 12000С. Диаграмма плавкости на рисунке 8.





|

 271,3 327,4
271,3 327,4
А В A
 960,8
960,8
 | |||
 |
Е
E
500 



Ag 100% Cu 100% Bi 100% Pb 100%
Рис.5.Диаграмма состояния Рис.6.Диаграмма состояния
системы Ag–Cu системы Bi–Pb
249. По диаграмме плавкости системы Ni–Sb (рис.4) установите формулы интерметаллических соединений, образуемых при сплавлении этих металлов.
| |||||||
 | |||||||
 | |||||||
 | |||||||

 1453
1453
1083 1063


 1000 1000
1000 1000
Cu 100% Ni 100% Au 100% Pt 100%
Рис.7.Диаграмма состояния Рис.8.Диаграмма состояния
системы Cu–Ni системы Au–Pt
250. При сплавлении лантан и таллий образуют интерметаллическое соединение, имеющее состав: 42% Tl и 58% La. Установите формулу этого соединения. Какой из металлов находится в свободном состоянии при охлаждении жидкого сплава, содержащего 30% Tl и 70% La? Какая масса этого металла содержится в 750 г сплава?
ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
| вар | Номера задач | ||||||||||
| вар | Номера задач | ||||||||||
| вар | Номера задач | ||||||||||
СПИСОК ЛИТЕРАТУРЫ
Основная
Лучинский Г.П. Курс химии.-М.: Высш.шк., 1985.-404 с.
Курс общей химии/Под ред. Н.В.Коровина.-М.: Высш.шк.,
1981.-125 с.
Глинка Н.Л. Общая химия.-Л.: Химия, 1989.-704 с.
Введение в общую химию/Под ред. Г.П.Лучинского.-М.: Высш.шк., 1980.-482 с.
Задачники
Глинка Н.Л. Задачи и упражнения по общей химии. - Л.: Химия, 1985.-240 с.
Кульман А.Г. Сборник задач по общей химии. - М.: Высш.шк., 1987.-232 с.
Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии.-М.: Высш.шк., 1980.-286 с.
Дополнительная
Ахметов Н.С. Общая и неорганическая химия.-М.: Высш. шк., 1988.-522 с.
Суворов А.В., Никольский А.Б. Общая химия.-Санкт-Петербург: Химия, 1997.-623 с.
Вариант № 4
1. По данным 1970г. (Автоматическая межпланетная станция “Венера-7”) на поверхности Венеры давление составляет 100*105 Па и температура близка к +500ºС. Представьте, что сосуд емкостью 1 л наполнен на поверхности Венеры газовой атмосферой, герметически закрыт и доставлен на Землю. Вычислите объем газа при земных условиях
2. Объясните, почему не существует молекула ClH3. хотя энергия связи Cl-H велика, а состояние Cl3+ устойчиво?
3. Стандартная энтальпия образования СО (г) равна 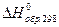 =-110,5 кДж/моль. При сгорании 1 моль СО выделяется 283,0 кДж теплоты. Вычислите стандартную энтальпию образования СО2 (г).
=-110,5 кДж/моль. При сгорании 1 моль СО выделяется 283,0 кДж теплоты. Вычислите стандартную энтальпию образования СО2 (г).
4. Какие массы безводного сульфата меди и медного купороса CuSO4  5H2O потребуются для приготовления раствора =1,084 г(
5H2O потребуются для приготовления раствора =1,084 г( см--3(CuSO) объемом 1 л, для которого 4)=0,08?
см--3(CuSO) объемом 1 л, для которого 4)=0,08?
5. Вычислить давление пара 10%-ного водного раствора сахара С12Н22О11 при 1000С.
6. Эквивалентная электрическая проводимость раствора хлорида натрия различной концентрации при 18°С имеет следующие значения:
| C, моль/л | 0,01 | 0,005 | 0,002 | 0,001 | 0,0005 | 0,0002 | 0,0001 |
| l, См·см2 | 10,20 | 103,8 | 105,6 | 106,5 | 107,2 | 107,8 | 108,1 |
найти значение эквивалентной электрической проводимости при бесконечном разбавлении, построив график зависимости l от  .
.
7. Из каких солей Pb(NO3)2; Al2(SO4)3; CuSO4; AgNO3; ZnSO4 – металл может быть выделен никелем? Напишите молекулярные и ионно-электронные уравнения.
8. Перманганат калия можно получить окислением манганата хлором
K2MnO4 + Cl2 = KMnO4 + 2KCl. Можно ли вместо хлора использовать Br2 или J2?
9. Составьте схему электродных процессов, суммарную реакцию и гальванический элемент, в котором возможно протекание указанной реакции. Рассчитайте значение стандартной электродвижущей силы. Pb + SO  + Sn2+ = PbSO4 + Sn
+ Sn2+ = PbSO4 + Sn
10. Как происходит атмосферная коррозия лужёного и оцинкованного железа при нарушении целости покрытия? Составьте электронные уравнения анодного и катодного процессов.







