Задачи для студентов-заочников
Специальности 290300
226. Минерал шпинель имеет состав, выражаемый формулой MgAl2O4. Привести химическое название этого вещества.
227. Состав доломитной горной породы может быть выражен общей формулой mСаСО3  nMgCO3. Вычислить m и n, если образец породы содержит: а) 28,17% Са; б) 21,74% MgO.
nMgCO3. Вычислить m и n, если образец породы содержит: а) 28,17% Са; б) 21,74% MgO.
228. Образец доломитной породы имеет состав, выражаемый формулой 3СаСО3  2MgCO3. Других примесей не содержит: а) вычислить процентное содержание СаО в образце; б) какой объем CO2 (при н.у.) выделится из 400 г этого образца, если он содержит 8% посторонних примесей (при обработке образца достаточным количеством, например, соляной кислоты)?
2MgCO3. Других примесей не содержит: а) вычислить процентное содержание СаО в образце; б) какой объем CO2 (при н.у.) выделится из 400 г этого образца, если он содержит 8% посторонних примесей (при обработке образца достаточным количеством, например, соляной кислоты)?
229. Минерал каолинит (белая глина) имеет состав, который может быть выражен формулой AlHSiO4  H2O. Привести химическое название соли; представить состав каолинита в виде соединения окислов.
H2O. Привести химическое название соли; представить состав каолинита в виде соединения окислов.
230. Для производства цемента используют известняк, содержащий 92% СаСО3, и глину, содержащую 48% SiO2. Сколько глины требуется взять на 1 т цемента, чтобы в полученном цементе окисел составлял 22%? Сколько процентов будет составлять окисел СаО?
231. Как получается негашеная известь? В чем заключается процесс гашения извести? Вычислите, сколько гашеной извести можно получить из 10 т известняка СаСО3?
232. Какие соединения металлов II группы широко применяются в строительном деле в качестве вяжущих материалов? Как они получаются, чем обусловлены их вяжущие свойства? Напишите уравнения соответствующих реакций.
233. Какой объем СО2 (н.у.) и какую массу Са(ОН)2 можно получить из известняка массой 1 т, если он содержит 90% СаСО3?
234. При смешивании портландцемента с водой трехкальциевый силикат, или алит 3СаО  SiO2, массовая доля которого в цементе 0,60, гидролитически разлагается с образованием Са(ОН)2 и гидросиликата кальция:
SiO2, массовая доля которого в цементе 0,60, гидролитически разлагается с образованием Са(ОН)2 и гидросиликата кальция:
yСаО  SiO2
SiO2  mH2O;
mH2O;
3СаО  SiO2 + nH2O = xСа(ОН)2 + yСаО
SiO2 + nH2O = xСа(ОН)2 + yСаО  SiO2
SiO2  mH2O. Какая масса воды (в килограммах) необходима для гидратации алита, содержащегося в 1 т цемента, при х = 2, у = 1 и m = 3?
mH2O. Какая масса воды (в килограммах) необходима для гидратации алита, содержащегося в 1 т цемента, при х = 2, у = 1 и m = 3?
235. Для производства цемента используются известняк с массовой долей СаСО3 0,92 и глина с массовой долей SiO2 0,48. Какая масса глины необходима на каждую тонну известняка, чтобы в полученном цементе оксид кальция составлял 0,62 массовой доли, а оксид кремния 0,22?
236. При сплавлении известняка массой 150 т с песком получился силикат кальция массой 150 т. Определить массовую долю примеси в известняке.
237. Рассчитать массу продукта, получаемого при обжиге
1 т известняка с массовыми долями СаСО3 0,90, MgСО3 0,06 и SiO2 0,04.
238. Определить массовую долю оксида углерода в известняке, имеющем следующий состав (в массовых долях): СаСО3 0,944, MgСО3 0,016 и других соединений, не являющихся карбонатами, 0,04.
239. При обжиге известняка массой 100 т получается 40 т оксида углерода (IV). Найти массовую долю карбоната кальция в известняке, допуская, что карбонат кальция разложился полностью.
240. Рассчитать расходный коэффициент известняка с массовой долей СаСО3 0,89 для получения негашеной извести с массовой долей СаО 0,94; СаСО3 (недопал) 0,012 и примесей 0,048.
241. На производственном объединении “Доломит” произведено извесняково-доломитовой крошки массой 200 тыс. т и доломитового щебня объемом 370 тыс.м3. Определить израсходованную массу доломитизированного известняка в пересчете на карбонат кальция и карбонат магния, если расходный коэффициент для известняково-доломитовой крошки составляет 1,06, а для доломитового щебня 1,4. Массовая доля СаСО3 в доломитизированном известняке 0,47, MgСО3 0,4 и глинистых примесей 0,08.
242. Вычислить выход продукта (в процентах), если на получение извести массой 1 т с массовой долей СаО 0,85 израсходовано известняка 1,7 т с массовой долей СаСО3 0,94.
243. Провести анализ реакции образования моноалюмината кальция СаО  Al2O3 (CA), являющегося главным минералом глиноземистого цемента, при использовании различных исходных материалов: Al2O3, Al(OH)3, CaO, CaCO3, Ca(OH)2. Исходные данные для расчета представлены в таблице.
Al2O3 (CA), являющегося главным минералом глиноземистого цемента, при использовании различных исходных материалов: Al2O3, Al(OH)3, CaO, CaCO3, Ca(OH)2. Исходные данные для расчета представлены в таблице.
| Соединение |  кДж/моль кДж/моль
|  кДж/моль кДж/моль
|
| СаО | –635,55 | –604,17 |
| Ca(OH)2 (тв) | –686,59 | –896,76 |
| CaCO3 | –1206,87 | –1128,76 |
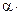 Al2O3 Al2O3
| –1669,83 | –1576,53 |
CaO  Al2O3 Al2O3
| –2321,28 | –2202,04 |
244. Определить теплоту образования Са(ОН)2 тв на основе реакций:
СаСО3  СаО + СО2 +
СаО + СО2 +  Н1;
Н1;
СаО + Н2О  Са(ОН)2 тв +
Са(ОН)2 тв +  Н2
Н2
245. Вычислить гидромодуль для образца цемента состава: 66% СаО, 21% SiO2, 6% Al2O3, 3,5% Fe2O3, 3,5% MgO.
246. Определите, для какого из минералов - магнезита MgСО3, кальцита СаСО3 или доломита СаMg(CO3)2 - прокаливание образцов одинаковой массы приведет к получению большего объема углекислого газа. Рассчитайте этот объем (м3, н.у.), если прокалена 1 т минерала.
247. Жженый гипс mСаSО4  nH2O готовят из обычного гипса xСаSО4
nH2O готовят из обычного гипса xСаSО4  yH2O выдерживанием последнего при 1300С. По данным анализа образец гипса содержит 20,9% (по массе) воды, а образец жженого гипса - только 6,2%. Установите химический состав обоих кристаллогидратов.
yH2O выдерживанием последнего при 1300С. По данным анализа образец гипса содержит 20,9% (по массе) воды, а образец жженого гипса - только 6,2%. Установите химический состав обоих кристаллогидратов.
248. Вычислите процентное содержание алюминия в природных минералах: корунде Al2O3, криолите AlF3  3NaF, глине Al2O3
3NaF, глине Al2O3  2SiO2
2SiO2  2H2O.
2H2O.
249. Месторождения криолита встречаются редко, поэтому его в основном получают искусственным путем по схеме:
Al(OH)3 + HF + Na2CO3  Na3[AlF6] + CO2 + H2O
Na3[AlF6] + CO2 + H2O
Относится ли эта реакция к окислительно-восстановительным? Сколько образуется граммов криолита, если в реакцию вступает 15,6 г гидроксида алюминия?
250. При строительстве Волго-Донского канала было уложено 2,9 млн.м3 бетона. Определить, сколько вагонов известняка для этого потребовалось (один товарный вагон имеет грузоподъемность 16,5 т), если принять, что 1 м3 бетона содержит в среднем 150 кг гашеной извести и что известняк, применяемый для получения извести, содержит в среднем 95% карбоната кальция.
Задачи для студентов-заочников
Специальности 290800
226. В 5 м3 воды содержится 250 г ионов кальция и 135 г ионов магния. Определить общую жесткость воды.
227. Жесткость воды равна 5,4 мг-экв ионов кальция в 1 л воды. Какое количество тринатрийфосфата Na3PO4 необходимо взять, чтобы понизить жесткость 1 т воды практически до нуля.
228. Определить общую жесткость воды методом комплексометрического титрования, если на 100 мл исследуемой воды пошло 8,5 мл 0,1 Н раствора трилона. Поправочный коэффициент трилона равен 1,05. Установлено, что 1 мл 0,1 Н раствора трилона Б соответствует 0,1 мг-экв ионов Са2+ и Mg2+.
229. Определить: 1) карбонатную жесткость воды, если на 100 мл исследуемой воды пошло 4,6 мл 0,1 Н раствора соляной кислоты. Поправочный коэффициент на нормальность кислоты равен 1,1; 2) постоянную жесткость воды, если общая жесткость воды равна 12 мг-экв/л.
230. Карбонатная жесткость воды равна 5 мг-экв/л. Определить содержание бикарбоната кальция в 10 м3 воды.
231. Для удаления карбонатной жесткости, обусловленной бикарбонатом кальция Са(НСО3)2, используют один из следующих реагентов: едкий натр, гашеную известь, тринатрийфосфат. Какое из названных веществ окажется наиболее эффективным, если взять их в одинаковых количествах? Ответ мотивировать уравнениями реакций и соответствующими расчетами.
232. При определении общей жесткости воды (Ж0) комплексометрическим методом на титрование 200 мл исследуемой воды пошло 5,5 мл 0,1 Н раствора трилона Б. Вычислить общую жесткость воды (в мг-экв/л).
233. Общая жесткость воды равна 11,7 мг-экв/л. Определить постоянную жесткость воды (Жн), если при определении временной жесткости (Жк), на 100 мл испытуемой воды при титровании пошло 6,5 мл 0,1 Н раствора соляной кислоты.
234. Чему равна жесткость природной воды, если содержание ионов магния в ней составляет 121,6 мг/л?
235. Определить жесткость воды (Ж0), если в 1 л ее содержится 0,1002 г ионов Са2+ и 0,03648 г ионов Mg2+.
236. Вода содержит 0,12 г/л растворенного бикарбоната кальция. Сколько нужно прибавить извести [Ca(OH)2] к 100 мл воды, чтобы осадить бикарбонат в виде карбоната?
237. В 2 л воды содержится 3 г бикарбоната кальция, 0,29 г бикарбоната магния и 1,4 г сульфата кальция. Сколько натриевого мыла (соли стеариновой кислоты) будет перерасходовано за счет жесткости при использовании 1000 л воды? Образование кальциевого (или маниевого) мыла протекает по реакции:
2С17Н35СООNa+Ca(HCO3)2  (С17Н35СОО)2Са+2NaHCO3
(С17Н35СОО)2Са+2NaHCO3
238. В 5,5 т технического коагулянта содержится 4675 кг Al2(SO4)3. Определить процентное содержание Al2(SO4)3 в глиноземе.
239. Какова жесткость воды, содержащей в литре 0,6 г хлористого кальция?
240. Минеральная вода “Нарзан” содержит 0,3894 г/л кальция и 0,0884 г/л магния. Какова общая жесткость этой воды?
241. Рассчитать жесткость воды, содержащей в 1 л:
а) 1 г хлористого кальция;
б) 1 мг-экв азотнокислого кальция;
в) 0,01 моль гидрокарбоната кальция.
242. Определить временную жесткость воды, содержащей в одном литре 100 мг:
а) гидрокарбоната кальция;
б) гидрокарбоната магния;
в) гидрокарбоната железа (II).
243. Сколько соды нужно для смягчения 10 л воды, содержащей 15 мг-экв/л ионов кальция?
244. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
245. Сколько граммов Са(ОН)2 необходимо прибавить к 1000 л воды, чтобы удалить временную жесткость, равную 2,86 мэкв/л?
246. Вычислить временную жесткость воды, зная, что на
реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1 Н раствора Hcl.
247. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния?
248. Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 мэкв/л. Определить массу гидрокарбоната в 1 л воды.
249. Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,60 мэкв/л?
250. В 1 л воды содержится 38 мг ионов Mg2+ и 108 мг ионов Са2+. Вычислить общую жесткость воды.






