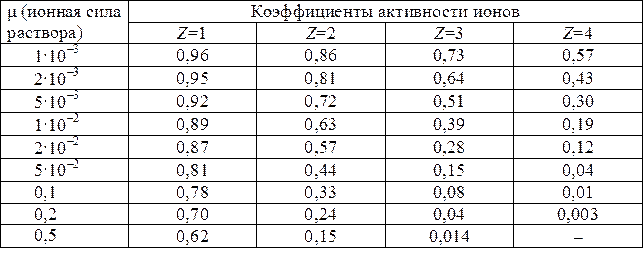
Пример 5. Имеется водный раствор, содержащий 0,02 н. AlCl3 и 0,03 н. CaCl2. Какова активность ионов этого раствора?
Решение. По условию задачи концентрации ионов в растворе  н.;
н.;  н.;
н.;  н.
н.

Из табл. 6 находим соответствующий коэффициент активности ионов:  – однозарядный ион;
– однозарядный ион;  – двухзарядный ион;
– двухзарядный ион; 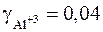 – трехзарядный ион. Окончательно получаем значения активности:
– трехзарядный ион. Окончательно получаем значения активности:
 н.;
н.;
 н.;
н.;
 н.
н.
7.6. Законы Рауля, Вант-Гоффа, изотонический коэффициент (i)
Находящиеся в растворе электролитов частицы – ионы и непродиссоциировавшие молекулы оказывают одинаковое влияние на физические свойства растворов электролитов. Физико-химические свойства растворов электролитов (давление пара, осмотическое давление, изменение температуры кипения, кристаллизации растворов) подчиняются тем же законам, что и растворов неэлектролитов, но с введением изотонического коэффициента i.
Изотонический коэффициент i – это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита.
Если в растворе находится N молекул электролита, степень диссоциации которого равна a, а каждая молекула распадается на n ионов, то всего частиц в растворе будет [1 + (n - 1) × a] × N, откуда
i = 1 + (n - 1) × a (7.10)
Из уравнения (7.10) можно определить степень диссоциации электролитов:
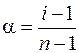 (7.11)
(7.11)
Законы, описывающие общие физические свойства растворов неэлектролитов и электролитов, приведены в табл. 7
.
Таблица 7
Законы для неэлектролитов и электролитов

Обозначения: D P – понижение давления пара растворителя над раствором; P 10 – парциальное давление пара растворителя над раствором; N 2 – мольная доля растворенного вещества; P 0 – давление пара над чистым растворителем; P 1 – давление пара растворителя над раствором; n 1 – число молей растворителя; n 2 – число молей растворенного вещества; D T замерз – понижение температуры замерзания (кристаллизации); K кр – криоскопическая константа растворителя, Сm – моляльная концентрация растворенного вещества; D T кип – повышение температуры кипения; К э – эбулиоскопическая константа растворителя; R – универсальная газовая постоянная (8,314 Дж/(моль×К); T – температура; С М – молярная концентрация раствора (табл. 8).
Пример 6. Давление пара растворителя над раствором, содержащим 5 г NaOH в 180 г воды, при 100 °С составляет 99000 Па. Вычислить кажущуюся степень диссоциации едкого натра.
Решение. Используя формулу (7.12), определим изотонический коэффициент

При 100 °С для воды P 0 = 101325 Па; число молей воды  ; число молей NaOH
; число молей NaOH  ; P 1 = 99000 Па, тогда
; P 1 = 99000 Па, тогда

Для определения a используем формулу (7.11):

кажущаяся степень диссоциации едкого натра a = 84 %.
Таблица 8






