Молярной массой химического эквивалента вещества Х называется масса одного моля (или 6,02·1023) его эквивалентов. Она обозначается М (1/z Х) и измеряется в г/моль или в кг/моль. Молярную массу химического эквивалента можно рассчитать по формуле:
М (1/z Х)= 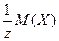
где  - фактор эквивалентности вещества Х;
- фактор эквивалентности вещества Х;
М (Х) – молярная масса вещества Х.
Если фактор эквивалентности равен единице (1/z = 1), то молярные массы вещества и его химического эквивалента численно совпадут.
Количество вещества эквивалента
Количеством вещества эквивалента называется отношение массы вещества (m) к молярной массе его эквивалента (М (1/z Х)):


С учётом того, что М (1/z Х)= 
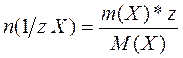
Единицей измерения количества вещества эквивалента является моль.
Молярная концентрация химического эквивалента
Молярной концентрацией химического эквивалента вещества Х называется отношение количества вещества эквивалента  к объему раствора (V), в котором оно находится. Она обозначается
к объему раствора (V), в котором оно находится. Она обозначается  и рассчитывается по формуле:
и рассчитывается по формуле:

Молярная концентрация химического эквивалента в системе СИ измеряется в моль/м3 или в моль/дм3 (моль/л).
Молярная концентрация вещества Х и молярная концентрация его химического эквивалента  связаны следующим отношением:
связаны следующим отношением:  = z·c(X)
= z·c(X)
Если фактор эквивалентности равен единице, то молярная
концентрация вещества и его химического эквивалента численно
совпадают:
 = c(Х)
= c(Х)
Во всех других случаях молярная концентрация химического эквивалента вещества в z раз больше молярной концентрации вещества.
На практике, кроме молярной концентрации химического эквивалента вещества (особенно в титриметрии), часто используют так называемый титр раствора (Т):
Т(Х) = 
Титр имеет размерность г/см3 и показывает, сколько граммов вещества содержится в 1см3 раствора.
Между молярной концентрацией химического эквивалента вещества и титром раствора существует следующая зависимость:
Т(Х) = 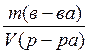 =
= 
c/(1/zX) = 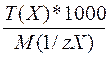
Зная титр раствора и его объем, можно определить массу растворенного вещества в растворе.
Закон эквивалентов
К реакциям, протекающим в стехиометрических соотношениях и заканчивающихся полным расходованием исходных веществ применим закон эквивалентов, который можно сформулировать
следующим образом:
количества веществ эквивалентов реагентов Х1 и Х2, вступивших между собой в химическую реакцию, равны друг другу, т.е.
n(1/z Х1) = n(1/z Х2)
где n(1/z Х1) – количество вещества эквивалента реагента Х1;
n(1/z Х2) – количество вещества эквивалента реагента Х2.
Если мы знаем массы расходованных исходных веществ и молярные массы их химических эквивалентов, то в этом случае закон эквивалентов можно записать иначе:

где m(X1) и m(X2) – массы исходных веществ Х1 и Х2, соответственно,
M(1/z Х1) и M(1/z Х2) – молярные массы химических эквивалентов исходных веществ.
Если взаимодействуют между собой растворы веществ Х1 и Х2, и мы знаем их использованные объёмы (V(X1), V(X2)), молярные концентрации химических эквивалентов с/(1/z Х1) и с/(1/z Х2), то закон эквивалентов записывается иначе:
c/(1/z Х1)·V1 = c/(1/z Х2)·V2
Такая математическая форма записи закона эквивалентов используется в титриметрическом методе анализа.
Следует отметить, что в литературе, посвященной титриметрическому анализу, до сих пор часто используется устаревшая форма обозначения молярной концентрации химического эквивалента вещества с помощью заглавной латинской буквы N. В этом случае закон эквивалентов запишется так:
N1V1 = N2V2
где N1 и N2 – молярные концентрации химических эквивалентов веществ, называемые иначе нормальными концентрациями, или нормальностью раствора.






