До речовин-окисників відносяться ті, які містять у своєму складі атоми, що здатні приймати електрони. До типових окисників відносяться неметали з високою електронегативністю (кисень, галогени, сірка, азот тощо) і сполуки, які містять метали і неметали в найвищих с.о. (KMnO4, K2CrO7, PbO2, NaBiO3, H2SO4, HNO3 і багато інших). Відновника є прості речовини з низькою електронегативністю (метали, водень, вуглець тощо) і сполуки, в яких атоми знаходяться в найвищому для даного елементу с.о.(галогеноводні та солі відповідних кислот, H2S та сульфіди, гідриди металів та інші). Сполуки, в яких атоми знаходяться в проміжній між мінімальною і максимальною ступенями окиснення проявляють так звану окисно-відновну двоїстість (наприклад HNO2 або Na2SO3).
Тому для визначення окисника і відновника слід проаналізувати ряд можливих для даного елементу ступенів окиснення. Так, хлор проявляє такі с.о. -1, 0, +1, +3, +4, +5, +7.
-1 +7
Тому можна говорити, що НСІ є відновником, КСІО4 –
+4
окисником, а СІО2 буде проявляти окисно-відновну двоїстість.
При складанні рівнянь ОВР слід дотримуватись такої послідовності. Розглянемо на прикладі взаємодії перманганату калію з йодидом калію у сірчанокислому середовищі.
1) Записуємо ліву частину рівняння
+7 -1
КМnO4 + KI + H2SO4 =
2) Шляхом аналізу можливих с.о. визначаємо окисник і відновник
Mn: 0, +2, +3, +4, +6, +7
І: -1, 0, +1, +3, +5, +7
Отже, окисником є КМnO4, а відновником КІ.
3) Записуємо продукти процесів окиснення відновника і відновлення окисника. При цьому спираємось на знання хімічних властивостей речовин. Так, відомо, що марганець у кислотному середовищі відновлюється до с.о. +2, а галогенідіони окислюються до вільних галогенів:
+7 -1 +2 0
KMnO4 + KI + H2SO4 = MnSO4 + I2 + ….
4) За допомогою електронно-іонної таблички знаходимо коефіцієнти при окиснику і відновнику
+7 +2
 Mn + 5e = Mn 2
Mn + 5e = Mn 2
-1 0
2I - 2e = 2I 5
2KMnO4 + 10KI + H2SO4 = 2MnSO4 + 5I2 + ….
5) Записуємо інші продукти реакції і підбираємо коефіцієнти при них:
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6К2SO4 + 8H2O
Ця реакція, в якій атоми-окисники (Mn) і атоми-відновники (І) належать до різних речовин, відноситься до міжмолекулярних ОВР.
В деяких ОВР, як наприклад в реакції розкладу бертолетової солі атоми
+5 -2 -1 0
2 КСІО3 = 2КСІ + 3О2
+5 -2
і окисника (СІ) і відновника (О) входять до складу однієї молекули. Такі процеси називають внутрішньо молекулярними.
Якщо ж атоми одного і того ж елементу входять до складу однієї молекули і виконують функції і окисника, і відновника, то маємо справу з реакціями самоокиснення-самовідновлення або диспропорціонування. Приклади такої ОВР є взаємодія:
+4 +5 +3
2NO2 + H2O = HNO3 + НNO2
+4 +5
N -1e = N
+4 +3
N + 1e = N
Зрозуміло, що в такі реакції вступають лише речовини, в яких є атоми з проміжними с.о.
3. На перебіг ОВР суттєво впливає характер середовища, в якому ця реакція відбувається. Класичним прикладом є поведінка такого типового окисника як перманганат калію у різних середовищах.
У кислотному середовищі KMnO4 є дуже сильним відновником, і марганець змінює свою ступінь окиснення з +7 до +2
+7 +3 +2 +5
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Це пояснюється тим, що іони водню необхідні для руйнування кисневого аніонного комплексу металу і переводу останнього в катіон
- + 2+
MnO4 + 8H +5e = Mn + 8H2O
В лужному середовищі перманганат іон перетворюється на манганат:
2KMnO4 + KNO2 + 2КОН = 2К2MnO4 + KNO3 + H2O
Цьому сприяє луг, який є джерелом іонів калію, по-перше, а
по-друге кисню
- 2-
2ОН = Н2О + О
В нейтральному середовищі взаємодія відбувається так:
+7 +3 +4 +5
2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2КОН
Велике значення для протікання ОВР має присутність речовин-комплексоутворювачів. Відомо, що деякі метали взаємодіють з азотною кислотою лише в присутності соляної, або фтороводневої кислот. Утворення аніонних хлоро-, або фторокомплексів спричиняє розчинення цих металів в азотній кислоті
0 +5 +4 +2
3Pt + 4HNO3 +18HCI = 3H2[PtCI6]+4NO + 8H2O
4. Окисно-відновні процеси можуть відбуватися і під дією електричного струму. І навпаки, ОВР може призводити до виникнення електричного струму. Такі реакції називаються електрохімічними. До них відноситься і електроліз, розклад речовин під дією електричного струму.
 Якщо в розплав NaCI занурити інертні (вугільні) електроди (мал.1), то хаотичний рух іонів перетворився в упорядкований
Якщо в розплав NaCI занурити інертні (вугільні) електроди (мал.1), то хаотичний рух іонів перетворився в упорядкований
двохсторонній, а на електродах будуть розряджатись катіони
 Na+ і аніони СІ-. В результаті на катоді виділяється металічний натрій, а на аноді – газоподібний хлор. Реакції, які відбуваються на електродах можна зобразити рівняннями:
Na+ і аніони СІ-. В результаті на катоді виділяється металічний натрій, а на аноді – газоподібний хлор. Реакції, які відбуваються на електродах можна зобразити рівняннями:
Na+ + 1e- = Na 2 на катоді
2CI- - 2e- = CI2 1 на аноді
2 Na+ + 2CI-→(електроліз) 2Na + CI2↑ або
2NaCI →(електроліз) 2Na + CI2↑
При електролізі розчинів в процесі можуть приймати участь і молекули води
2H2O + 2e- = 2H2↑ + 2OH- на катоді
2CI- – 2e- = CI2↑ на аноді
2H2O + 2CI- →(електроліз) H2↑+ CI2↑ + 2OH- або
2H2O + 2NaCI→(електроліз) H2 ↑+ CI2↑ + 2NaOH
При відновленні металів на катоді можливі 3 випадки:
1) Катіони металів з низьким стандартним електродним потенціалом Е0 більшим, ніж у водню (Cu2+- Au3+) практично повністю відновлюється на катоді;
2) Катіони металів з низькими значеннями Е0 (Li+ - AI3+) не відновлюються, замість них відновлюється вода з виділенням водню;
3) Катіони, що мають Е0 між AI3+ i H+ відновлюються однозначно з молекулами води.
При одночасній присутності декількох катіонів у водному розчині вони відновлюються у порядку зменшення Е0. Наприклад, спочатку Аg+ (Е0 = +0,80 В), потім Cu2+(Е0 =+0,34 В) і нарешті Fe2+(Е0 = - 0,44 В).
Характер реакцій, що відбуваються на аноді, залежить як від наявності молекул води, так і від матеріалу аноду. Аноди поділяються на нерозчинні (вугілля, графіт, платина, іридій), які ще називають інертними, і розчинні (мідь, срібло, цинк, кадмій, нікель та інші метали).
1) На нерозчинному аноді в процесі електролізу відбувається окиснення аніонів або молекул води. При цьому без кисневі аніони (S2-, I-, CI-, Br-) легко окислюються. Якщо ж розчин
2- - 2- 3-
містить аніони кисневмісних кислот (SO4, NO3, CO3, PO4 тощо), то окислюються не ці аніони, а молекули води:
2H2O – 4е = О2↑ + 4Н+
2) Розчинний анод при електролізі сам піддається окисненню, тобто надсилає електрони у зовнішнє коло і розчиняється, наприклад: Ni = Ni2++2e, Ni – 2e = Ni2+.
5. Кількісна характеристика процесів електролізу визначається законами електролізу, які відкрив М. Фарадей у 30-х роках ХІХ ст., які можна подати як один:
Маса електроліту, який піддався електролізу, а також маси речовин, що утворилась на електродах, прямо пропорційна кількості електрики, яка пройшла через розплав або розчин, і молярним масам еквівалентів відповідних речовин.

або, оскільки Q = I*t, де t – час (сек)
 де F – стала (число) Фарадея 96500 Кл/моль
де F – стала (число) Фарадея 96500 Кл/моль 
Приклади:
1. Через розчин сірчаної кислоти пропускали струм силою 6 амперів на протязі 1,5 години. Обчислити масу води, яка розклалася і об’єм водню, що виділився.
 |
І = 6А 


t = 1,5год
 m(H2O) -?
m(H2O) -? 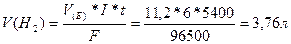
V(H2) -?
2. В результаті пропускання електричного струму силою 2,5 амперів на протязі 30 хвилин на катоді виділилось 2,77 металу. Визначити молярну масу еквіваленту металу.
 |
І = 2,5 А 
t = 30хв.
 m (Me) = 2,77г
m (Me) = 2,77г
Е(Me) -?
6. Гальванічним елементом називається любий пристрій, який дає можливість одержувати електричний струм за рахунок проведення тієї чи іншої хімічної реакції. При цьому ОВР повинні проходити роздільно на різних електродах.
Класичним прикладом гальванічного елементу є елемент Даніеля-Якобі, схема якого зображена на малюнку.
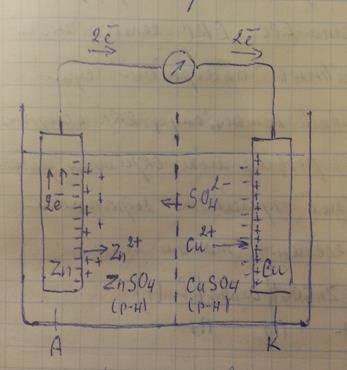
У зв’язку з виникненням подвійного електричного шару на поверхні металів виникає стрибок потенціалів. Це пояснюється реакціями, які відбуваються на електродах
на аноді: Zn – 2e = Zn 2+ - окиснення
на катоді: Cu 2+ + 2e = Cu - відновлення
Якщо ж замкнути електричний ланцюг (з’єднати електроди через гальванометр), то надлишок електронів потече від цинкової пластинки до мідної. Одночасно в розчині електроліту почнеться
2-
міграція катіонів Zn 2+ до катоду, і аніонів SO4 до аноду (електропровідність другого роду).
Найбільша різниця потенціалів даного елементу називають електрорушійною силою, скорочено ЕРС. ЕРС гальванічного елементу дорівнює алгебраїчній сумі окремих стрибків потенціалу, які існують на поверхнях розділу між окремими фазами.
В електрохімії прийнято зображати гальванічний елемент таким чином:
(-) Сu│ Zn│ZnSO4││ СuSO4│ Сu (+)
Пк П- Пд П+
Всього ми бачимо 4 поверхні розділу фаз і відповідно 4 стрибки потенціалів:
Пк – контактна різниця потенціалів;
Пд – дифузійна різниця потенціалів;
П-, П+ - різниці потенціалів, які виникають на поверхні розділу метал-розчин на аноді і катоді. Отже:
Е = П+ + П- + Пк + Пд
Звичайно ж, найбільший вклад в ЕРС дають П- і П+
Гальванічні елементи, подібні розглянутому цинк-мідному, є одноразовими, бо неможливе їх повернення у початковий стан шляхом проведення зворотної хімічної реакції. Проте існують хімічні джерела струму, де така зворотна реакція (зарядка) можлива, їх називають акумуляторами.
7. При визнанні ЕРС найважливішими складовими частинами є П- і П+, які залежать від природи металів. Для практичних цілей необхідно знати умовні величини, що характеризують різні електроди по відношенню до потенціалу будь-якого електроду, вибраного як стандарт. У якості такого електроду порівняння вибрано нормальний водневий електрод, потенціал якого за певних умов прийнято за «0». За стандартні (нормальні) умови прийняті такі Р(н2) = 1бар, t = 250С (Т = 2980 К), а (н2) = аН+ =1 моль/л (а – активність, величина пропорційна концентрації). Звичайно ж, в таких саме умовах перебуває електрод, стандартний потенціал (Е0) якого визначається.
Наприклад, Е0 цинку можна визначити, склавши такий гальванічний елемент
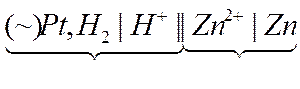
нормальний цинковий
водневий електрод
електрод
На електродах відбуваються процеси
Zn2+ + 2e- = Zn0
H2 = 2H+ + 2e-
ЕРС такого елементу Е0 = -0,763В і є стандартним електродним потенціалом цинку. Для переходу Cu 2+ + 2e = Cu Е0 = +0,337В.
На практиці температури і активності відрізняються від стандартних.
Для визначення електродних потенціалів у цих випадках застосовується формула, запропонована В.Нернстом





(при розв’язнанні задач для розведених розчинів можна активності замінювати концентраціями).
Знання нормальних електродних потенціалів дає можливість обчислити ЕРС гальванічного елементу. Так, за нормальних умов ЕРС елементу Даніеля-Якобі дорівнює
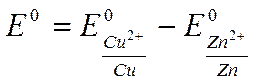
E0 = +0,337 – (-0,763) = 1,1В
Експериментальне значення Е0 = 1,087В дещо відрізняється (на 0,013В) від розрахункового, тому що в останньому не врахований дифузійний потенціал.
Аналогічно розраховуються, користуючись формулою Нернста, ЕРС в реальних умовах. Для цього часто використовують спрощену формулу Нернста

Як ми бачили в розділі про електроліз, знання стандартних електродних потенціалів дозволяє передбачити порядок виділення речовинна електродах з розплавів і розчинів.






