Гидролиз – частный случай сольволиза – взаимодействия растворенного в-ва и растворителя. Это реакция разрушения в-ва водой. Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений. Возможны 4 варианты: вода+соли, обр. сильной к-той и слабым осн. (NH4Cl+H2O=NH3*H2O+HCl), +соли, обр.сильн.осн. и слабой к-той(CH3COONa+H2O=CH3COOH+NaOH), + соли, обр. слабой к-той и слабым осн. (4CN+H2O=NH3*H2O+HCN), + соли, обр. сильной к-той и сильным основанием – не диссоциируют.
Степень гидролиза измеряется отношением кол-ва гидролизованного в-ва к общему кол-ву растворенного в-ва. Концентрация недиссоциированных молекул воды в разбавленных р-рах практически постоянна при t=const, произведение константы равновесия поэтому так же будет величиной постоянной и станет называться константой гидролиза.
В биопроцессах – ферментативный гидролиз, гидролиз АТФ – получение энергии.
30.Буферные системы. Определение, классификация
Буферные растворы – растворы, рН которых сохраняется практически постоянным при разбавлении или при добавлении небольших количеств сильной к-ты или сильного основания. Классификация: 1)Кислотные A-/HA: ацетатные CH3COOH+CH3COONa (обл. действ pH 3,8-5,8) CH3COOH/CH3COO- (сл. К-та и сопр. Осн.); гидрокарбонатные H2CO3+NaHCO3 (5,4-4,7) H2CO3/HCO3-; основные 4OH+NH4Cl (8,2-10,2), солевые KH2PO4+K2HPO4 (6,2-8,2), белковые.
Ур-е Гендерсона-Гессельбаха:

Буферная емкость – величина, характерная способность буф. р-ра противодействовать смещению р-ии среды при добавлении сильных кислот или сильных оснований. БЕ для к-ты = n(H+)/v буф р-ра *dpH; n(H+) = C(H к-ты)*v(к-ты);; БЕ для осн = = n(OH-)/v буф р-ра *dpH; n(H+) = C(H осн)*v(осн). БЕ зависит от абсолютных значений С и от соотношения концентр. Компонентов.
31.Буферные системы крови. Понятие…
Буферные системы крови обеспечивают постоянную величину рН при поступлении в нее кислых или основных продуктов.В крови есть четыре буферные системы: гемоглобиновая (HHb/Hb+), бикарбонатная, фосфатная(H2PO4/HPO4^2-), белковая.
Пределы pH крови: pH 7,0 (ацидоз) <- 7,4 -> 7,8 (алкалоз).
Т.к. в крови имеется определенное отношение между щелочными и кислотными эквивалентами, то говорят о кислотно-щелочном равновесии. Сумма солей щелочных Ме слабых к-т, содержащихся в крови, определяет щелочной резерв. Величину щелочного резерва крови характеризуют тем кол-вом CO2, которое модет быть связано 100мл крови при давлении CO2=40 мм р.т., примерно соотв. Обычному давлению в альвеолярном воздухе.
32.Химическая кинетика: основные понятия, предмет изучения.
Это наука о скорости хим. реакций. Делится на формальную (макроскопически на основе эксперимент. данных) и молекулярную (на основе молекул. Данных частиц.). Реагенты – в-ва, вступающие в реакцию. Продукты р-ии – обр. в-ва. Промежуточные в-ва. Хим. р-ия, протекающая в пределах одной фазы – гомогенная. На границе раздела фаз – гетерогенная. Скорость гомогенной реакции = кол-ву в-ва, вступившего в р-ию или образовавшегося в реакции за единицу времени в единице объема с-мы. Скорость р-ии – кол-во в-ва, вступившего в р-ию при р-ии за единицу времени.

Средняя скорость накопление продукта р-ии = 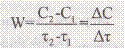 , величина скорости в каждый момент времени -
, величина скорости в каждый момент времени - 






