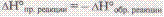’имическа€ термодинамика
“ермодинамика Ц наука о взаимопревращени€х теплоты и энергии. —истема Ц тело или группа взаимодействующих тел, физически или мысленно выделенный их окружающей среды. —истемы Ц бывают открытые (▲m≠0, ▲Q≠0), закрытые (▲m=0, ▲Q≠0) (изолированные (▲m=0, ▲Q=0). √омогенные (когда каждый параметр во всех част€х системы имеет одно и то же значение) и гетерогенные) (из нескольких фаз, где св-ва системы резко мен€ютс€). —осто€ние системы: равновесное (посто€нство всех свойств во времени), стационарное (посто€нство за счет обмена в-вом, ≈ между с-мой и окс.ср.) и переходное (изменение св-в во времени). ¬нутренн€€ энерги€ Ц полна€ ≈ с-мы, котора€ равна сумме потенциальной и кинетической энергии всех частиц данной с-мы: U=Eкин.+≈пот.) ѕараметры состо€ни€: масса, давление, концентраци€., кол-во в-ва, температура. »нтенсивные параметры не завис€т от числа частиц, экстенсивные завис€т. ‘-и€ состо€ни€: люба€ термодинамическа€ величина, завис€ща€ только от текущего состо€ни€ системы. ѕроцесс Ц переход системы из одного состо€ни€ в другое, сопровождаетс€ изменени€ми любого параметра. “еплота Ц мера беспор€дочного, хаотичного движени€ тел или частиц. –абота Ц мера упор€доченного движени€, ‘аза Ц гомогенна€ часть с-мы, отделенна€ от других частей поверхностью раздела.
2.“ипы процессов: самопроизвольныеЕ
—амопроизвольные Ц процессы, не требующие затраты ≈. Ќесамопроизвольные -требуют ≈, т.е. вли€ние извне. Ќеобратимые Ц если хоть 1 из промежуточных состо€ний неравновесно. »зобарный Ц процесс, протекающий в системе при посто€нном давлении и посто€нной массе идеального гада. »зохорный Ц происходит при посто€нном объеме. »зотермический Ц при посто€нной температуре. јдиабатический Ц когда система не обмениваетс€ теплотой с окружающим пространством.
ѕервое начало термодинамики
—истема обладает особым св-вом, изменение которого Ц сумма теплоты и работы: ▲≈=Q+W. Ёнерги€ не исчезает и не возникает, а лишь переходит из одной своей формы в другую в строго эквивалентных соотношени€ =>невозможен вечный двигатель первого рода. ћатематическое выражение: Q=A±▲U=▲U±ρ*±▲ν Ёнтальпи€ Ц ф-и€ состо€ни€., изменение которой = теплоте, полученной с-мой в изобарном процессе: Qp=H2-H1=▲H; Ёнтальпи€ образовани€ Ц изменение энтальпии системы ▲ЌЂаї сопровождаетс€ образованием 1 моль соединени€ Ђаї из простых в-в. –авна разности алгебраической суммы энтальпий образовани€ всех продуктов р-ии и алгебраической суммы обр. всех исходных продуктов: ΔH = ∑(nΔH)продукты - ∑(nΔH)реагенты
Ёнтальпи€ сгорани€: равна разности алгебр. —уммы теплот сгорани€ исх. ¬-в и алгебраической суммы теплот сгорани€ конечных продуктов р-ии.
»зменение энтальпии в ходе химической реакции.
Ёкзотермические и эндотермические процессы - это хим. р-ии, сопровождающиес€ поглощением или выделением теплоты. Ёкзотермические - выделение ≈ из с-мы в окр. —реду. ¬ р-те энтальпи€ с-мы уменьшаетс€ (▲Ќ<0). Ёндотермические Ц поглощение ≈ из окр. —р. => энтальпи€ повышаетс€ (▲Ќ>0). Ёнтальпи€ зависит от кол-ва в-ва, t и ρ => изменение энтальпии в ре-те хим. реакции определ€ют при стандартных услови€х: давление Ц 760 мм –“ = 101325ѕа; температура Ц 298 =25∞C. —тандартна€ энтальпи€ обр. простых в-в в их наиболее термодинамически устойчивом агрегатном состо€нии при стандартных принимаетс€ = 0. —ложного в-ва - = энтальпии реакции получени€ 1 моль данного в-ва из простых в-вв при стандартных услови€х. „исловые значени€ стандартных энтальпий искать в справочнике.
|
|
|
«акон √есса. —ледстви€ из закона √есса.
”становлен в 1840 г. “епловой эффект хим. реакции зависит только от природы и состо€ни€ исходных в-в и конечных продуктов и не зависит от пути реализации процесса, т.е. от пути перехода от начального состо€ни€ к конечному. ¬ соответствии с законом √есса: ▲Ќ=▲Ќ1+▲Ќ2. —ледстви€: энтальпи€ р-ии равна разности алгебраической суммы энтальпий образовани€ всех продуктов р-ии и алгебраической суммы энтальпий образовани€ всех исходных в-в: 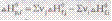
Ёнтальпи€ р-ии сгорани€ = разности алгебраической суммы теплот сгорани€ исходных в-в и алгебраической суммы теплот сгорани€ конечных продуктов.
Ёнтальпи€ пр€мой р-ии численно равна энтальпии обратной р-ии, но противоположна по знаку.