86. Оксид углерода(II) взаимодействует с
| 1) | хлором |
| 2) | oксидом железа(III) |
| 3) | карбонатом кальция |
| 4) | соляной кислотой |
| 5) | кислородом |
| 6) | раствором гидроксида калия |
87. Оксид углерода(IV) взаимодействует с
| 1) | оксидом кальция |
| 2) | концентрированной азотной кислотой |
| 3) | раствором карбоната калия |
| 4) | магнием |
| 5) | кислородом |
| 6) | оксидом серы(VI) |
88. Оксид кремния(IV) взаимодействует с
| 1) | углеродом |
| 2) | соляной кислотой |
| 3) | плавиковой кислотой |
| 4) | oксидом азота(V) |
| 5) | карбонатом кальция |
| 6) | кислородом |
89. Оксид серы(IV) взаимодействует с
| 1) | сероводородом |
| 2) | концентрированной серной кислотой |
| 3) | раствором гидроксида натрия |
| 4) | азотом |
| 5) | азотной кислотой |
| 6) | оксидом углерода(IV) |
90. Оксид фосфора(V) взаимодействует с
| 1) | водой |
| 2) | концентрированной серной кислотой |
| 3) | углекислым газом |
| 4) | раствором гидроксида калия |
| 5) | оксидом магния |
| 6) | кислородом |
91. Оксид серы(VI) взаимодействует с
| 1) | кислородом |
| 2) | водой |
| 3) | углекислым газом |
| 4) | гидроксидом натрия |
| 5) | оксидом лития |
| 6) | азотной кислотой |
92. Плавиковая (фтороводородная) кислота взаимодействует с
| 1) | сульфатом натрия |
| 2) | кислородом |
| 3) | oксидом кремния(IV) |
| 4) | гидроксидом калия |
| 5) | оксидом натрия |
| 6) | ортофосфорной кислотой |
93. Хлороводородная кислота взаимодействует с
| 1) | серебром |
| 2) | цинком |
| 3) | oксидом углерода(IV) |
| 4) | сульфидом железа(II) |
| 5) | нитратом серебра |
| 6) | сероводородом |
94. Сероводород взаимодействует с
| 1) | гидроксидом бария |
| 2) | сульфатом меди(II) |
| 3) | азотной кислотой |
| 4) | соляной кислотой |
| 5) | бромидом натрия |
| 6) | азотом |
95. Аммиак взаимодействует с
| 1) | серной кислотой |
| 2) | водородом |
| 3) | медью |
| 4) | оксидом меди(II) |
| 5) | гидроксидом меди(II) |
| 6) | гидроксидом натрия |
96. Метан взаимодействует с
| 1) | бромоводородом |
| 2) | кислородом |
| 3) | бромом |
| 4) | гидроксидом бария |
| 5) | перманганатом калия |
| 6) | азотной кислотой |
97. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | CO2(избыт.) + Ca(OH)2 → | 1) | СаСО3 | |||
| Б) | CO2 + Ca(ОH)2(избыт.) → | 2) | СаСО3 + H2 | |||
| В) | CO2 + CaO → | 3) | СаСО3 + H2O | |||
| Г) | СО2 + СаСО3 + Н2О → | 4) | Са(НСО3)2 | |||
| 5) | Са(НСО3)2 + H2 | |||||
| 6) | Са(НСО3)2 + H2O | |||||
| А | Б | В | Г | |||
98. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | SO2 + Ba(ОH)2(избыт.) → | 1) | BаSО3 | |||
| Б) | SO2(избыт.) + Ba(OH)2 → | 2) | BаSО4 | |||
| В) | SO2 + BaO → | 3) | BаSО3 + H2O | |||
| Г) | SO3 + BaO → | 4) | BаSО4 + H2O | |||
| 5) | Bа(НSО3)2 + H2O | |||||
| 6) | Bа(НSО3)2 | |||||
| А | Б | В | Г | |||
99. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | NO2 + NaОH → | 1) | N2O | |||
| Б) | N2O5 + NaOH → | 2) | N2O3 | |||
| В) | N2O3 + NaOH → | 3) | NaNO2 + H2O | |||
| Г) | NO + NO2 → | 4) | NaNO3 + H2O | |||
| 5) | NaNO2 + NaNO3 + H2O | |||||
| 6) | NH4NO3 + H2O | |||||
| А | Б | В | Г | |||
100. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | NO2 + H2O → | 1) | SO3 + N2O4 | |||
| Б) | NO2 + H2O 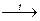
| 2) | SO3 + NO | |||
| В) | NO2 + O2 + H2O → | 3) | HNO3 | |||
| Г) | NO2 + SO2 → | 4) | HNO2 + NO | |||
| 5) | HNO3 + NO | |||||
| 6) | HNO2 + HNO3 | |||||
| А | Б | В | Г | |||
101. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | HNO3(разб.) + Ag → | 1) | AgNO3 + H2 | |||
| Б) | HNO3(конц.) + Ag → | 2) | AgNO3 + NO + H2O | |||
| В) | HNO3(разб.) + Al(ОН)3 → | 3) | AgNO3 + NO2 + H2O | |||
| Г) | HNO3(конц.) + Al 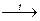
| 4) | Al(NO3)3 + NO + H2O | |||
| 5) | Al(NO3)3 + NO2 + H2O | |||||
| 6) | Al(NO3)3 + H2О | |||||
| А | Б | В | Г | |||
102. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | HNO3(разб.) + FeO → | 1) | Fe(NO3)2 + H2O | |||
| Б) | HNO3(конц.) + Fe3O4 → | 2) | Fe(NO3)3 + H2O | |||
| В) | HNO3(разб.) + Fe(OH)2 → | 3) | Fe(NO3)2 + NO + H2O | |||
| Г) | HNO3(конц.) + Fe(OH)3 → | 4) | Fe(NO3)3 + NO + H2O | |||
| 5) | Fe(NO3)2 + NO2 + H2O | |||||
| 6) | Fe(NO3)3 + NO2 + H2O | |||||
| А | Б | В | Г | |||
103. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | HNO3(конц.) + P → | 1) | P2O3 + NH3 + H2O | |||
| Б) | HNO3(конц.) + PH3 → | 2) | H3PO4 + NO2 + H2O | |||
| В) | HNO3(конц.) + S → | 3) | SO2 + NH4NO3 + H2O | |||
| Г) | HNO3(конц.) + H2S → | 4) | H2SO4 + NO2 + H2O | |||
| А | Б | В | Г | |||
104. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | H2SO4(р-р) + Cu(OH)2 → | 1) | СuSO4 + H2O | |||
| Б) | H2SO4(конц.) + Cu 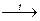
| 2) | СuSO4 + H2 | |||
| В) | H2SO4(р-р) + CuО → | 3) | CuSO4 + SO2 + H2O | |||
| Г) | SO3 + Cu(OH)2 → | 4) | CuSO4 | |||
| 5) | CuO + H2O | |||||
| А | Б | В | Г | |||
105. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | Cr + … 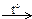 Cr(NO3)3 + NO2 + H2O Cr(NO3)3 + NO2 + H2O
| 1) | H2SO4(разб.) | ||||
| Б) | Cr + … 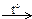 Fe2(SO4)3 + SO2 + H2O Fe2(SO4)3 + SO2 + H2O
| 2) | H2SO4(конц.) | ||||
| В) | CrO + … → CrSO4 + H2O | 3) | Cr(NO3)2 | ||||
| Г) | CrO + HNO3(конц.) → … + NO2 + H2O | 4) | Cr(NO3)3 | ||||
| 5) | HNO3(разб.) | ||||||
| 6) | HNO3(конц.) | ||||||
| А | Б | В | Г | ||||
106. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | C + … 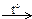 CO2 + SO2 + H2O CO2 + SO2 + H2O
| 1) | H2SO4(разб.) | ||||
| Б) | S + … 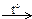 SO2 + H2O SO2 + H2O
| 2) | H2SO4(конц.) | ||||
| В) | I2 + SO2 + H2O → … + H2SO4 | 3) | H2SO3 | ||||
| Г) | I2 + HNO3 → … + NO + H2O | 4) | SO3 | ||||
| 5) | HI | ||||||
| 6) | HIO3 | ||||||
| А | Б | В | Г | ||||
107. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | Cl2 + … → NaCl + NaClO + H2O | 1) | NaOH(гор.) | ||||
| Б) | Сl2 + … → NaCl + NaClO3 + H2O | 2) | NaOH(хол.) | ||||
| В) | H2S + SO2 → H2O + … | 3) | H2SO4 | ||||
| Г) | … + H2SO4 → S + I2 + H2O | 4) | S | ||||
| 5) | HI | ||||||
| 6) | HIO3 | ||||||
| А | Б | В | Г | ||||
108. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | SiH4 + H2O → … + H2 | 1) | Si | ||||
| Б) | SiH4 + O2 → … + H2O | 2) | H2 | ||||
| В) | Si + NaOH + H2O → Na2SiO3 + … | 3) | SiO | ||||
| Г) | SiCl4 + H2 → … + HCl | 4) | SiO2 | ||||
| 5) | SiH4 | ||||||
| А | Б | В | Г | ||||
109. Объем оксида углерода(II), который можно сжечь в кислороде объемом 35 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
110. Объем оксида серы(IV), который может вступить во взаимодействие с кислородом объемом 40 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
111. Масса воды, образующейся при сгорании 15 л (н.у.) водорода в 15 л (н.у.) кислорода, равна _________ г. (Запишите число с точностью до целых.)
112. Объем аммиака (н.у.), образующегося при взаимодействии 60 л (н.у.) водорода с 40 л (н.у.) азота, равен _________ л. (Запишите число с точностью до целых.)
113. Объем сернистого газа (н.у.), образующегося при сгорании 6,4 г серы в 10 л (н.у.) кислорода, равен _________ л. (Запишите число с точностью до сотых.)
114. Объем хлороводорода (н.у.), образующегося при взаимодействии 15 л (н.у.) водорода с 20 л (н.у.) хлора, равен _________ л. (Запишите число с точностью до целых.)
115. Объем воздуха (н.у.), необходимый для полного сгорания 36 г углерода, равен _________ л. (Запишите число с точностью до целых.)
116. Объем воздуха (н.у.), необходимый для полного сгорания 20 л (н.у.) сероводорода, равен _________ л. (Запишите число с точностью до целых.)
117. Объем углекислого газа (н.у.), выделившегося при взаимодействии 20 г карбоната кальция с избытком соляной кислоты, равен _________ л. (Запишите число с точностью до сотых.)
118. Объем сероводорода (н.у.), выделившегося при взаимодействии 4,4 г сульфида железа(II) с избытком соляной кислоты, равен _________ л. (Запишите число с точностью до сотых.)
119. Объем газа (н.у.), выделившегося при взаимодействии 12,8 г меди с избытком концентрированной азотной кислоты, равен _________ л. (Запишите число с точностью до сотых.)
120. Объем газа (н.у.), выделившегося при взаимодействии 32,4 г серебра с избытком разбавленной азотной кислоты, равен _________ л. (Запишите число с точностью до сотых.)
121. 16 г оксида серы(VI) растворили в 150 мл воды. Массовая доля кислоты в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
122. 14,2 г оксида фосфора(V) растворили в 200 мл воды. Массовая доля кислоты в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
123. 44,8 л аммиака (н.у.) растворили в 1 л воды. Массовая доля аммиака в растворе равна _________ %. (Запишите число с точностью до сотых.)
124. В 140 г 20%-ного раствора серной кислоты растворили 10 г оксида серы(VI). Массовая доля серной кислоты в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
125. В 200 г 10%-ного раствора ортофосфорной кислоты растворили 14,2 г оксида фосфора(V). Массовая доля ортофосфорной кислоты в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
126. В 120 г 10%-ного раствора аммиака растворили 28 л аммиака (н.у.). Массовая доля аммиака в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
Высокий уровень сложности
129. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaCl → Cl2 → KClO3 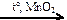 X1
X1 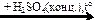 X2
X2 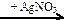 X3
X3
Укажите условия протекания реакций.
130. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
H2S 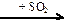 X1
X1 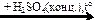 X2
X2 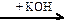 X3
X3 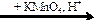 X4
X4 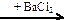 X5
X5
131. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
HNO3(конц.) 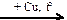 X1
X1 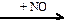 X2
X2 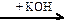 X3
X3 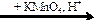 X4
X4 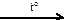 X3
X3
132. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P 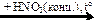 X1
X1 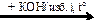 X2
X2 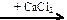 X3 → P
X3 → P 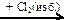 X4
X4
Укажите условия протекания реакций.
133. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С 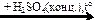 X1
X1 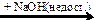 X2
X2 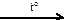 X3 → X1 → C
X3 → X1 → C
Укажите условия протекания реакций.
134. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Si 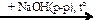 X1
X1 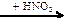 X2
X2 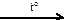 X3 → Si
X3 → Si 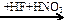 X4
X4
Укажите условия протекания реакций.
135. (С4) В 150 мл 20%-ного раствора серной кислоты (плотность 1,14 г/мл) растворили 4,0 г оксида серы(VI). К полученному раствору добавили 100 мл 18%-ного раствора хлорида бария (плотность 1,18 г/мл). Определите массу выпавшего осадка и массовые доли веществ в растворе над осадком.
136. (С4) Сероводород, полученный в результате взаимодействия между сульфидом железа(II) массой 8,8 г и раствором соляной кислоты объемом 75 мл с массовой долей НСl 20% (плотность 1,14 г/мл), пропустили через раствор сульфата меди(II) массой 150 г с массовой долей соли 16%. Определите массовую долю серной кислоты в полученном растворе.
137. (С4) Сернистый газ, полученный в результате полного сгорания 2,24 л (н.у.) сероводорода, пропустили через 218,6 мл 18,3%-ный раствор гидроксида натрия (плотность 1,20 г/мл). Определите массовые доли веществ в полученном растворе.
138. (С4) Хлор, полученный в результате взаимодействия 31,6 г перманганата калия с избытком концентрированной соляной кислоты, пропустили через горячий 16,26%-ный раствор гидроксида калия объемом 359,4 мл (плотность 1,15 г/мл). Определите массовые доли веществ в растворе после окончания реакции.
139. (С4) Хлороводород, выделившийся при нагревании 2,34 г хлорида натрия с избытком концентрированной серной кислоты, пропустили через 204 г 5,00%-ного раствора нитрата серебра. Определите массу выпавшего осадка и массовые доли веществ в растворе над осадком
140. (С4) Водород объемом 3,36 л (н.у.) пропустили над нагретой серой массой 6,4 г. Полученный в результате реакции газ пропустили через 67,97%-ный раствор азотной кислоты объемом 100 мл (плотность 1,40 г/мл). Определить массовые доли веществ в полученном растворе.






