27. Оксид кальция реагирует с
| 1) | гидроксидом натрия | 4) | соляной кислотой |
| 2) | оксидом бария | 5) | углекислым газом |
| 3) | водой | 6) | хлоридом натрия |
28. Оксид хрома(III) реагирует с
| 1) | хлоридом калия | 4) | азотной кислотой |
| 2) | гидроксидом бария | 5) | алюминием |
| 3) | водой | 6) | сульфатом натрия |
29. Оксид железа(II) реагирует с
| 1) | оксидом кальция | 4) | углеродом |
| 2) | водой | 5) | водородом |
| 3) | серной кислотой | 6) | гидроксидом натрия |
30. Оксид лития реагирует с
| 1) | оксидом серы(VI) | 4) | гидроксидом натрия |
| 2) | водой | 5) | оксидом стронция |
| 3) | соляной кислотой | 6) | нитратом натрия |
31. И оксид бария, и оксид алюминия реагируют с
| 1) | NaOH | 4) | H2O |
| 2) | HCl | 5) | CaO |
| 3) | SO3 | 6) | HNO3 |
32. И оксид натрия, и оксид цинка реагируют с
| 1) | H2O | 4) | NH3 |
| 2) | H2SO4 | 5) | CaO |
| 3) | CH3COOH | 6) | N2O5 |
33. Установите соответствие между формулой оксида и его типом.
| ФОРМУЛА ОКСИДА | ТИП ОКСИДА | |||||
| А) | Na2O | 1) | основный | |||
| Б) | ZnО | 2) | амфотерный | |||
| В) | MnO | 3) | кислотный | |||
| Г) | Mn2O7 | |||||
| А | Б | В | Г | |||
34. Установите соответствие между формулой оксида и его типом.
| ФОРМУЛА ОКСИДА | ТИП ОКСИДА | |||||
| А) | Cr2O3 | 1) | основный | |||
| Б) | BeO | 2) | амфотерный | |||
| В) | MgO | 3) | кислотный | |||
| Г) | MnO2 | |||||
| А | Б | В | Г | |||
35. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Zn + H2O → | 1) | ZnO + H2 | |||
| Б) | Zn + KOH + H2O → | 2) | Zn(OH)2 + H2 | |||
| В) | ZnO + KOH 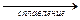
| 3) 4) 5) 6) | Zn(NO3)2 + NH4NO3 + H2O Zn(NO3)2 + NO2 + H2O K2ZnO2 + H2О K2[Zn(OH)4] + H2 | |||
| Г) | Zn + HNO3(конц.) → | |||||
| А | Б | В | Г | |||
36. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | NaOH + FeSO4 → | 1) | Fe(OH)3 + NaHSO4 | |||
| Б) | NaOH + Fe2(SO4)3 → | 2) | Fe(OH)3 + Na2SO4 | |||
| В) | NaOH(избыток) + CO2 → | 3) | Fe(OH)2 + NaHSO4 | |||
| Г) | NaOH + CO2(избыток) → | 4) | Fe(OH)2 + Na2SO4 | |||
| 5) | Na2CO3 + H2O | |||||
| 6) | NaHCO3 | |||||
| А | Б | В | Г | |||
37. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Al + KOH + H2O → | 1) | K[Al(OH)4] | |||
| Б) | Al + HNO3(конц.) 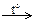
| 2) | K[Al(OH)4] + H2 | |||
| В) | KOH(р-р) + Al(OH)3 → | 3) | Al(NO3)3 + H2 | |||
| Г) | KOH + Al2O3 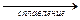
| 4) 5) 6) | Al(NO3)3 + NO2 + H2O KAlO2 + H2 KAlO2 + H2O | |||
| А | Б | В | Г | |||
38. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Ca + H2O → | 1) | CaO + H2 | |||
| Б) | Ca + HNO3(конц.) → | 2) | Са(OH)2 + H2 | |||
| В) | CaO + HNO3 → | 3) | Са(OH)2 + H2O | |||
| Г) | Ca(OH)2 + HNO3 → | 4) | Ca(NO3)2 + H2 | |||
| 5) | Ca(NO3)2 + H2O | |||||
| 6) | Ca(NO3)2 + NO2 + H2O | |||||
| А | Б | В | Г | |||
39. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | Mg + H2SO4(разб.) → | 1) | MgSO4 + H2 | |||
| Б) | Mg + H2SO4(конц.) → | 2) | MgSO4 + H2O | |||
| В) | MgO + HNO3 → | 3) | MgSO4 + SO2 + H2O | |||
| Г) | Mg(OH)2 + HNO3 → | 4) | Mg(NO3)2 + H2O | |||
| 5) | Mg(NO3)2 + NO2 + H2O | |||||
| 6) | Mg(NO3)2 + H2 | |||||
| А | Б | В | Г | |||
40. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | |||||
| А) | CuO + H2SO4 → | 1) | СuSO4 + H2 | |||
| Б) | Cu + H2SO4(конц.) → | 2) | СuSO4 + H2O | |||
| В) | Cu + HNO3(разб.) → | 3) | CuSO4 + SO2 + H2O | |||
| Г) | Cu(OH)2 + HNO3 → | 4) | Cu(NO3)2 + H2 | |||
| 5) | CuNO3)2 + NO + H2O | |||||
| 6) | Cu(NO3)2 + H2O | |||||
| А | Б | В | Г | |||
41. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | MgO + H2SO4 → MgSO4 + … | 1) | H2 | ||||
| Б) | Ag + H2SO4(конц.) → Ag2SO4 + … + H2O | 2) | H2O | ||||
| В) | Fe + HNO3(разб.) → Fe(NO3)3 + … + H2O | 3) | SO2 | ||||
| Г) | Fe(OH)3 + HNO3 → Fe(NO3)3 + … | 4) | H2S | ||||
| 5) | NO2 | ||||||
| 6) | NO | ||||||
| А | Б | В | Г | ||||
42. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | Na + H2O → … + H2 | 1) | O2 | ||||
| Б) | NaH + … → NaOH + H2 | 2) | Na2O | ||||
| В) | NaOH + ZnO 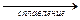 … + H2O … + H2O
| 3) 4) 5) 6) | H2O Na2[Zn(OH)4] Na2ZnO2 NaOH | ||||
| Г) | NaOH + Zn(OH)2 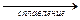 … + H2O … + H2O
| ||||||
| А | Б | В | Г | ||||
43. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | MgO + HCl → MgCl2 + … | 1) | H2SO4(конц.) | ||||
| Б) | Ag + … → Ag2SO4 + SO2 + H2O | 2) | H2SO4(разб.) | ||||
| В) | Cu + … → Cu(NO3)2 + NO + H2O | 3) | HNO3(конц.) | ||||
| Г) | Cu(OH)2 + HNO3 → Cu(NO3)2 + … | 4) | HNO3(разб.) | ||||
| 5) | H2 | ||||||
| 6) | H2O | ||||||
| А | Б | В | Г | ||||
44. Установите соответствие между схемой реакции и формулой недостающего в ней вещества.
| СХЕМА РЕАКЦИИ | ФОРМУЛА ВЕЩЕСТВА | ||||||
| А) | FeO + … → FeSO4 + H2O | 1) | H2SO4(конц.) | ||||
| Б) | FeO + HNO3(конц.) → … + NO2 + H2O | 2) | H2SO4(разб.) | ||||
| В) | Fe + … 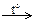 Fe(NO3)3 + NO2 + H2O Fe(NO3)3 + NO2 + H2O
| 3) | Fe(NO3)2 | ||||
| Г) | Fe + … 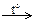 Fe2(SO4)3 + SO2 + H2O Fe2(SO4)3 + SO2 + H2O
| 4) | Fe(NO3)3 | ||||
| 5) | HNO3(конц.) | ||||||
| 6) | HNO3(разб.) | ||||||
| А | Б | В | Г | ||||
45. Определите объем 20%-ного раствора соляной кислоты (плотность 1,098 г/мл), необходимый для полного растворения оксида магния массой 4,0 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
46. Определите объем 14%-ного раствора азотной кислоты (плотность 1,078 г/мл), необходимый для полного растворения оксида меди(II) массой 1,6 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
47. Определите объем 12%-ного раствора гидроксида натрия (плотность 1,131 г/мл), необходимый для полной нейтрализации серной кислоты массой 4,9 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
48. Определите объем 8%-ного раствора гидроксида калия (плотность 1,069 г/мл), необходимый для полной нейтрализации уксусной кислоты массой 18 г. Ответ: _________ мл. (Запишите число с точностью до десятых.)
49. К 20,00 г 16%-ного раствора cульфата меди(II) прилили 40,00 г 10%-ого раствора гидроксида натрия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
50. К 25,00 г 15,2%-ного раствора cульфата железа(II) прилили 30,00 г 11,2%-ого раствора гидроксида калия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
51. К 30,00 г 16,25%-ного раствора хлорида железа(III) прилили 50,00 г 12%-ого раствора гидроксида натрия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
52. К 9,5 г 20,0%-ного раствора хлорида магния прилили 20,0 г 22,4%-ого раствора гидроксида калия. Масса образовавшегося осадка равна _________ г. (Запишите число с точностью до сотых.)
53. Максимальный объем (н.у.) углекислого газа, который может быть полностью поглощен известковой водой массой 530 г с массовой долей Са(ОН)2 0,14%, равен _________ л. (Запишите число с точностью до тысячных.)
54. Максимальный объем (н.у.) сернистого газа, который может быть полностью поглощен раствором гидроксида натрия массой 100 г с массовой долей NaOH 10%, равен _________ л. (Запишите число с точностью до десятых.)
55. Минимальный объем 10%-ного раствора гидроксида калия (плотность 1,08 г/мл), который необходим для поглощения сероводорода объемом 6,72 л (н.у.), равен _________ мл. (Запишите число с точностью до десятых.)
56. Минимальный объем 16%-ного раствора гидроксида натрия (плотность 1,18 г/мл), который необходим для поглощения углекислого газа объемом 4,48 л (н.у.), равен _________ мл. (Запишите число с точностью до десятых.)
57. Объем 40%-ного раствора гидроксида калия (плотность 1,4 г/мл), который может вступить в реакцию с фенолом массой 18,8 г, равен _________ мл. (Запишите число с точностью до целых.)
Высокий уровень сложности
58. (С4) Натрий массой 4,6 г полностью растворили в 80 мл воды. К полученному раствору щелочи прилили 86 мл 20%-ного раствора серной кислоты (плотность 1,14 г/мл). Определите массовую долю соли в полученном растворе.
59. (С4) Углекислый газ, полученный в результате полного сгорания 0,448 л (н.у.) этилена, пропустили через раствор гидроксида калия объемом 165,9 мл с массовой долей КОН 4,20% (плотность 1,045 г/мл). Определите массовые доли веществ в полученном растворе.
60. (С4) К 30%-ному раствору серной кислоты объемом 20 мл (плотность 1,219 г/мл) осторожно прилили 18,25%-ный раствор гидроксида натрия (плотность 1,200 г/мл) до полной нейтрализации кислоты. Определите объем прилитого раствора щелочи. Какой объем воды надо прибавить к полученному раствору, чтобы массовая доля соли в нем стала равна 10%?
61. (С4) К 8,3%-ному раствору серной кислоты объемом 45,0 мл (плотность 1,05 г/мл) осторожно прилили 10,0%-ный раствор гидроксида калия (плотность 1,092 г/мл) до полной нейтрализации кислоты. Определите объем прилитого раствора щелочи. Сколько граммов сульфата калия надо добавить к полученному раствору, чтобы массовая доля соли в нем стала равна 10,0%?
62. (С4) Углекислый газ, выделившийся в результате взаимодействия 30 г карбоната кальция с избытком азотной кислоты, пропустили через 230,8 мл 11,03%-ного раствора КОН (плотность 1,10 г/мл). Определите массовые доли солей в полученном растворе.
63. (С4) Сероводород, выделившийся в результате взаимодействия 4,4 г сульфида железа(II) с избытком соляной кислоты, пропустили через 28,54 мл 10,1%-ный раствор гидроксида натрия (плотность 1,11 г/мл). Определите массовые доли солей в полученном растворе.
64. (С4) К 290,9 мл 10%-ного раствора сульфата цинка (плотность 1,107 г/мл) прилили 163,7 мл 11,01%-ного раствора гидроксида натрия (плотность 1,110 г/мл). Определите массовые доли солей в растворе над полученным осадком.
65. (С4) К 145,1 мл 16%-ного раствора хлорида алюминия (плотность 1,15 г/мл) прилили 292,3мл 12,08%-ного раствора гидроксида калия (плотность 1,11 г/мл). Определите массовые доли солей в растворе над полученным осадком.
Общая характеристика неметаллов в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характерные химические свойства простых веществ-неметаллов. Водородные соединения неметаллов. Оксиды неметаллов и соответствующие им гидроксиды
Базовый уровень сложности
1. В ряду химических элементов Te – Se – S – O способность неметаллов присоединять электроны
| 1) | уменьшается | 3) | не изменяется |
| 2) | увеличивается | 4) | изменяется периодически |
2. В ряду химических элементов F – Cl – S – P неметаллические свойства
| 1) | уменьшаются | 3) | не изменяются |
| 2) | увеличиваются | 4) | изменяются периодически |
3. В ряду химических элементов Si – P – S – O окислительная способность
| 1) | уменьшается | 3) | не изменяется |
| 2) | увеличивается | 4) | изменяется периодически |
4. В ряду химических элементов O – N – C – Si восстановительная способность
| 1) | уменьшается | 3) | не изменяется |
| 2) | увеличивается | 4) | изменяется периодически |
5. В ряду химических элементов В – С – N – O увеличивается
| 1) | число электронных энергетических уровней |
| 2) | радиус атомов |
| 3) | электроотрицательность |
| 4) | восстановительная способность |
6. В ряду химических элементов N – P – As уменьшается
| 1) | радиус атомов |
| 2) | число внешних электронов |
| 3) | число электронных энергетических уровней |
| 4) | окислительная способность |
7. В ряду химических элементов F – Cl – Br – I не изменяется
| 1) | электроотрицательность |
| 2) | число электронных энергетических уровней |
| 3) | число внешних электронов |
| 4) | окислительная способность |
8. Азот не может проявлять в соединениях степень окисления
| 1) | + 5 | 2) | + 4 | 3) | - 3 | 4) | - 4 |
9. Сера не может проявлять в соединениях степень окисления
| 1) | + 6 | 2) | + 4 | 3) | - 3 | 4) | - 2 |
10. Оксиды с общей формулой ЭО3 и ЭО2 образуют элементы подгруппы
| 1) | углерода | 2) | азота | 3) | кислорода | 4) | фтора |
11. Оксиды с общей формулой Э2О5 и летучие водородные соединения с общей формулой ЭН3 образуют элементы подгруппы
| 1) | углерода | 2) | азота | 3) | кислорода | 4) | фтора |
12. Оксиды с общей формулой ЭО2 и летучие водородные соединения с общей формулой ЭН4 образуют элементы подгруппы
| 1) | углерода | 2) | азота | 3) | кислорода | 4) | фтора |
13. Кислоты состава НЭО3 и Н3ЭО4 образует химический элемент
| 1) | углерод | 2) | азот | 3) | сера | 4) | фосфор |
14. Соли состава КЭО3 и КЭО4 образует химический элемент
| 1) | фтор | 2) | хлор | 3) | сера | 4) | азот |
15. Соли состава К2ЭО4 и КНЭО4 образует химический элемент
| 1) | бор | 2) | углерод | 3) | азот | 4) | сера |
16. Соли состава К2Э и КНЭ образует химический элемент
| 1) | азот | 2) | углерод | 3) | селен | 4) | хлор |
17. Аллотропия характерна для
| 1) | кислорода | 2) | фтора | 3) | азота | 4) | водорода |
18. Аллотропия не характерна для
| 1) | углерода | 2) | азота | 3) | кислорода | 4) | серы |
19. Молекулярную кристаллическую решетку имеет
| 1) | графит | 2) | кремний | 3) | бор | 4) | йод |
20. Атомную кристаллическую решетку имеет
| 1) | кислород | 3) | белый фосфор |
| 2) | алмаз | 4) | бром |
21. Окислительные свойства наиболее ярко выражены у
| 1) | F2 | 2) | Сl2 | 3) | Br2 | 4) | I2 |
22. Восстановительные свойства наиболее ярко выражены у
| 1) | хлора | 2) | серы | 3) | фосфора | 4) | углерода |
23. Окислительные свойства сера проявляет при взаимодействии с
| 1) | кислородом | 2) | хлором | 3) | фтором | 4) | водородом |
24. Окислительные свойства углерод проявляет при взаимодействии с
| 1) | кислородом | 2) | водородом | 3) | серой | 4) | фтором |
25. Окислительные свойства углерод проявляет при взаимодействии с
| 1) | оксидом алюминия | 3) | азотной кислотой |
| 2) | углекислым газом | 4) | кальцием |
26. Окислительные свойства кремний проявляет при взаимодействии с
| 1) | кислородом | 2) | углеродом | 3) | магнием | 4) | азотом |
27. Окислительные свойства фосфор проявляет при взаимодействии с
| 1) | хлором | 2) | кислородом | 3) | серой | 4) | магнием |
28. Окислительные свойства водород проявляет при взаимодействии с
| 1) | бромом | 2) | кислородом | 3) | углеродом | 4) | калием |
29. Восстановительные свойства водород проявляет при взаимодействии с
| 1) | оксидом меди (II) | 3) | алюминием |
| 2) | натрием | 4) | кальцием |
30. Восстановительные свойства сера проявляет при взаимодействии с
| 1) | кислородом | 2) | водородом | 3) | натрием | 4) | углеродом |
31. Восстановительные свойства углерод проявляет при взаимодействии с
| 1) | водородом | 2) | кислородом | 3) | кремнием | 4) | кальцием |
32. Восстановительные свойства азот проявляет при взаимодействии с
| 1) | кислородом | 2) | водородом | 3) | магнием | 4) | углеродом |
33. И углерод, и сера проявляют окислительные свойства при взаимодействии с
| 1) | кислородом | 3) | фтором |
| 2) | водородом | 4) | азотной кислотой |
34. И азот, и фосфор проявляют восстановительные свойства при взаимодействии с
| 1) | кальцием |
| 2) | водородом |
| 3) | кислородом |
| 4) | натрием |
35. И водород, и углерод проявляют окислительные свойства при взаимодействии с
| 1) | oксидом железа(III) |
| 2) | кальцием |
| 3) | кислородом |
| 4) | фтором |
36. Восстановительные свойства не способен проявлять
| 1) | фтор | 2) | водород | 3) | азот | 4) | углерод |
37. При комнатной температуре азот реагирует с
| 1) | кислородом | 3) | кальцием |
| 2) | литием | 4) | водородом |
38. При комнатной температуре сера реагирует с
| 1) | кислородом |
| 2) | водородом |
| 3) | концентрированной азотной кислотой |
| 4) | ртутью |
39. И бром, и водород способны реагировать с
| 1) | гидроксидом калия | 3) | натрием |
| 2) | водой | 4) | соляной кислотой |
40. И хлор, и йод способны реагировать с
| 1) | бромидом натрия | 3) | азотом |
| 2) | гидроксидом натрия | 4) | кислородом |
41. Фосфор образует соединения, в которых его степень окисления равна – 3, при взаимодействии с каждым из двух веществ
| 1) | хлором и концентрированной серной кислотой |
| 2) | кальцием и натрием |
| 3) | концентрированной азотной кислотой и серой |
| 4) | магнием и кислородом |
42. Азот образует соединения, в которых его степень окисления равна – 3, при взаимодействии с каждым из двух веществ
| 1) | водородом и магнием |
| 2) | водородом и кислородом |
| 3) | фтором и натрием |
| 4) | алюминием и кислородом |
43. Сера образует соединения, в которых ее степень окисления равна – 2, при взаимодействии с каждым из двух веществ
| 1) | магнием и водородом |
| 2) | калием и кислородом |
| 3) | хлором и гидроксидом натрия |
| 4) | азотной кислотой и кальцием |
44. Йод образует соединения, в которых его степень окисления равна – 1, при взаимодействии с каждым из двух веществ
| 1) | водородом и хлорной кислотой |
| 2) | алюминием и азотной кислотой |
| 3) | кальцием и сероводородом |
| 4) | хлором и магнием |
45. Какие из приведенных утверждений о водороде верны?
А. Водород является самым распространенным химическим элементов во Вселенной.
Б. В химических реакциях водород способен проявлять как окислительную, так и восстановительную способность.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
46. Какие из приведенных утверждений о галогенах верны?
А. Электронная конфигурация внешнего электронного уровня атомов галогенов ns2np5.
Б. С щелочными металлами галогены образуют соединения с ионным типом связи.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
47. Какие из приведенных утверждений о фторе верны?
А. Высшая степень окисления фтора равна + 7.
Б. В химических реакциях фтор может проявлять только окислительные свойства.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
48. Какие из приведенных утверждений об элементах подгруппы кислорода верны?
А. Высшая степень окисления всех элементов подгруппы кислорода равна +6.
Б. Все элементы подгруппы кислорода являются типичными неметаллами.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
49. Какие из приведенных утверждений о кислороде и его свойствах верны?
А. В свободном состоянии кислород способен существовать в виде двух аллотропных модификаций.
Б. Кислород взаимодействует с галогенами с образованием оксидов.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
50. Какие из приведенных утверждений о сере и ее свойствах верны?
А. На внешнем электроном уровнеатома серы в невозбужденном состоянии содержится два неспаренных электрона.
Б. В реакциях с металлами сера проявляет окислительные свойства.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
51. Какие из приведенных утверждений об азоте и его свойствах верны?
А. Высшая валентность азота равна V.
Б. Азот образует очень прочную, достаточно инертную двухатомную молекулу.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
52. Какие из приведенных утверждений о фосфоре и его свойствах верны?
А. Белый фосфор образует молекулярную кристаллическую решетку.
Б. Наиболее устойчивая степень окисления фосфора равна + 5.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
53. Какие из приведенных утверждений об элементах подгруппы углерода верны?
А. Все элементы подгруппы углерода являются неметаллами.
Б. Восстановительная активность элементов подгруппы углерода уменьшается с увеличением заряда ядра их атомов.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
54. Какие из приведенных утверждений об углероде и его свойствах верны?
А. Углерод образует несколько простых веществ.
Б. Для углерода наиболее характерны окислительные свойства.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
55. Какие из приведенных утверждений о кремнии и его свойствах верны?
А. Кристаллическая решетка кремния подобна кристаллической решетке алмаза.
Б. Кремний широко используется в полупроводниковой технике.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
56. Наиболее сильные кислотные свойства проявляет
| 1) | H2O | 2) | H2S | 3) | H2Se | 4) | H2Te |
57. Наиболее слабой кислотой является
| 1) | HF | 2) | HCl | 3) | HBr | 4) | HI |
58. Кислотные свойства не проявляет
| 1) | HF | 2) | HBr | 3) | H2Se | 4) | CH4 |
59. Восстановительные свойства не проявляет
| 1) | HF | 2) | HCl | 3) | HBr | 4) | HI |
60. Наиболее сильные окислительные свойства проявляет
| 1) | HClO | 2) | HClO2 | 3) | HClO3 | 4) | HClO4 |
61. Наиболее сильные кислотные свойства проявляет
| 1) | H2SO3 | 2) | H2SO4 | 3) | H2SeO3 | 4) | H2SeO4 |
62. Наиболее сильные кислотные свойства проявляет
| 1) | H2SO3 | 2) | H2SO4 | 3) | HBrO3 | 4) | HClO4 |
63. Наиболее сильные кислотные свойства проявляет
| 1) | HClO | 2) | HClO2 | 3) | HСlO3 | 4) | HClO4 |
64. Наиболее слабые кислотные свойства проявляет
| 1) | H3РO4 | 2) | H3AsO4 | 3) | H2SeO4 | 4) | HClO4 |
65. C водой не взаимодействует
| 1) | CO2 | 2) | SO2 | 3) | SeO2 | 4) | SiO2 |
66. Оксид кремния(IV) не взаимодействует с
| 1) | oксидом серы(VI) | 3) | гидроксидом натрия |
| 2) | углеродом | 4) | плавиковой кислотой |
67. Между собой взаимодействуют
| 1) | SO2 и H2S | 3) | P2O5 и HNO3 |
| 2) | CO2 и SO3 | 4) | SiO2 и H2O |
68. Между собой не взаимодействуют
| 1) | N2O5 и H2SO4 | 3) | P2O5 и KOH |
| 2) | CO2 и СaO | 4) | SO2 и H2O |
69. Оксид серы (VI) взаимодействует с каждым из трех веществ
| 1) | H2O, CO2, NaOH |
| 2) | H2O, MgO, HNO3 |
| 3) | CaO, KOH, H2O |
| 4) | Ca(OH)2, SiO2, BaO |
70. Оксид кремния(IV) взаимодействует с каждым из трех веществ
| 1) | H2O, O2, NaOH |
| 2) | K2CO3, CaO, HNO3 |
| 3) | C, KOH, SO2 |
| 4) | HF, Mg, CaCO3 |
71. Oксид серы(IV) взаимодействует с каждым из трех веществ
| 1) | O2, H2S, NaOH |
| 2) | CO2, H2SO4, H2O |
| 3) | CaO, KOH, SiO2 |
| 4) | HCl, MgO, CaSiO3 |
72. Oксид фосфора(V) взаимодействует с каждым из двух веществ
| 1) | серной кислотой и гидроксидом кальция |
| 2) | водой и оксидом натрия |
| 3) | оксидом серы(VI) и оксидом кальция |
| 4) | азотной кислотой и углекислым газом |
73. И с оксидом кремния(IV), и с оксидом серы(VI) взаимодействует каждое из трех веществ
| 1) | H2O, Li2O, NaOH |
| 2) | CO2, CaO, H2SO4 |
| 3) | Na2O, KOH, СаO |
| 4) | HNO3, P2O5, BaO |
74. Между собой взаимодействуют
| 1) | H2SO4 и P2O5 | 3) | H2SO4 и H2CO3 |
| 2) | конц. H2SO4 и Au | 4) | конц. H2SO4 и H2S |
75. Между собой взаимодействуют
| 1) | HCl и NaHCO3 | 3) | HCl и SiO2 |
| 2) | HCl и Cu | 4) | HCl и H2S |
76. Между собой взаимодействуют
| 1) | конц. HNO3 и конц. HСl | 3) | HNO3 и Au |
| 2) | HNO3 и H2SO4 | 4) | HNO3 и SiO2 |
77. Между собой не взаимодействуют
| 1) | конц. H2SO4 и Cu | 3) | H2SO4 и Na2CO3 |
| 2) | H2SO4 и CuO | 4) | H2SO4 и СO2 |
78. Между собой не взаимодействуют
| 1) | HCl и Zn | 3) | HCl и K2SO3 |
| 2) | HCl и Ag | 4) | HCl и FeS |
79. Между собой не взаимодействуют
| 1) | HNO3 и H2S | 3) | HNO3 и Ag |
| 2) | HNO3 и Pt | 4) | HNO3 и CaSO3 |
80. И с соляной, и с азотной кислотой взаимодействует каждое из трех веществ
| 1) | Cu, NaHCO3, NaOH |
| 2) | P2O5, CaO, H2S |
| 3) | K2O, Cu(OH)2, Mg |
| 4) | Na2SO3, Au, BaO |
81. И с хлороводородной, и с серной кислотой взаимодействует каждое из трех веществ
| 1) | Ag, BaCl2, NaOH |
| 2) | K2CO3, Mg(OH)2, Zn |
| 3) | Ca(NO3)2, BaO, H2S |
| 4) | Na3PO4, SO2, BaO |
82. Какие из приведенных утверждений о неметаллах и свойствах их соединений верны?
А. Неметаллы образуют только кислотные оксиды.
Б. Водородные соединения неметаллов имеют молекулярное строение.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
83. Какие из приведенных утверждений о неметаллах и свойствах их соединений верны?
А. Кислотные свойствагалогеноводородов увеличиваются с ростом заряда ядра атомов образующих их химических элементов-неметаллов, расположенных в одной группе периодической системы Д.И. Менделеева.
Б. С ростом степени окисления химического элемента-неметалла кислотные свойства образуемого этим элементом гидроксида увеличиваются.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
84. Какие из приведенных утверждений о свойствах соединений неметаллов верны?
А. В молекулах летучих водородных соединений химическая связь между атомами ковалентная полярная.
Б. Кислотные свойства оксидов и соответствующих им гидроксидов увеличивается с ростом заряда ядра атомов образующих их химических элементов-неметаллов, расположенных в одной группе периодической системы Д.И. Менделеева.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
85. Какие из приведенных утверждений о соединениях неметаллов верны?
А. Летучие водородные соединения, образованные химическими элементами IV группы, проявляют основные свойства.
Б. Оксиды и кислоты, в которых атом неметалла проявляет промежуточную степень окисления, проявляют окислительно-восстановительную двойственность.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |






