Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям.
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Шредингер, учитывая двойственность поведения ℮, предложил описывать состояние ℮ в атоме с помощью уравнения волновой механики: Нψ = Еψ
Н – оператор Гамильтона, ψ – волновая функция, Е – полная энергия ℮.
Основные выводы:
1) ψ не имеет физического смысла, она может принимать -,+ и мнимые значения, физический смысл имеет ψ2 – вероятность нахождения ℮
2) задача имела решение только для сферически симметричных систем. Для более сложных атомов решение имело место относительно некоторых целых чисел n,l,m – квантовые числа.
Квантовые числа.
Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме.
1) n – главное кв. ч., является энергетическим уровнем, принимает значения целых натур. чисел; хар-ет энергетическое состояние ℮ или его удаленность от ядра атома: чем дальше находится ℮ от ядра, тем выше его энергия. N=2n2 N – емкость эл. слоя (кол-во ℮)
2) l – орбитальное кв.ч., является энергетическим подуровнем, принимает значения от 0 до n-1; хар-ет форму эл. облака. l = 0 S l = 1P l = 2 d l = 3 f
3) m – магнитное кв. ч., принимает значения m = (-l, 0, +l), общее кол-во m = 2l + 1; хар-ет ориентацию ℮ во внешнем магн. поле.
4) s – спиновое кв. ч., вращаясь по орбитали вокруг ядра, имеет собственный момент движения, т.е. он способен вращаться вокруг своей оси по и против часовой стрелки → характ. вращение ℮ вокруг своей оси; принимает значения s = ± ½
Правила Клечковского
Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы n+l. Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы n+l, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа n.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6 s следующий электрон появляется на орбитали 5 d, а не 4 f, и только затем происходит заселение четырнадцатью электронами 4 f орбиталей, затем продолжается и завершается заселение десятиэлектронного состояния 5 d. Аналогичная ситуация характерна и для орбиталей 7 s, 6 d и 5 f.
1) при возрастании заряда ядра атома, последовательное заполнение ℮ энергет. уровней начинается с меньшего значения суммы главного и орбитального кв.ч.
2) в случае одинаковой суммы n+1 последовательность заполнения энергет. уровней начинается с меньшего значения главного кв.ч.
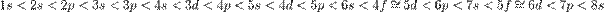
Основные хар-ки атома
1) радиус атома – половина кратчайшего расстояния между центрами ядер, сильно зависит от внешних термодинамических условий состояния системы, поэтому говорят об эффективных радиусах. В ПСХЭ радиус ↑ в рядах и ↓ в периодах.
2) энергия ионизации I – наименьшая энергия, которую необходимо приложить к нейтральному атому для удаления ℮ с атома для превращения его в катион э0-℮→э+; энергия необходимая для удаления 1 моля электронов от одного моля атомов какого-либо элемента - первой энергией ионизаци; хар-ет Ме св-ва элемента (чем меньше его значение, тем большими Ме св-вами обладает элемент). Различают потенциал ионизации по 1, 2, 3 и т.д. ступеням ионизации. Напр. если эл. формула заканчивается на S2, то для отрыва 1го и 2го ℮ требуется примерно одинаковая энергия (I1=I2); если на p6s1 → I1˂˂I2, то энергия ионизации для 2го ℮ на p-подуровне требуется гораздо большая. Т.о. можно судить об эл. строении атома. В ПСХЭ потенциальная ионизация ↑ в периодах и ↓ в рядах.
3) сродство к ℮ E - работа, которую необходимо затратить для присоединения ℮ к атому, т.е. при превращении атома в анион (-): э0+℮→э-+Еср.; хар-ет неМе св-ва элемента.
4) электроотрицательность – хар-ет способность того или инного атома притягивать к себе ℮, хар-ет хим. активность элемента; можно определить как полусумму энергии ионизации и сродства к ℮
а) Все атомы состоят из положительно заряженного ядра и обращающихся вокруг него отрицательно заряженных частиц - электронов.
б) Электрический заряд электрона qe = - 1.6022 .10-19 Кл - наименьший электрический заряд, обнаруженный экспериментально, и это дало повод назвать его элементарным зарядом, а заряды других частиц и структур на микроуровне - измерять в элементарных зарядах.
в) Атомный номер элемента z - есть не что иное, как суммарное количество электронов в атоме.
г) Поскольку устойчивый атом любого химического элемента электронейтрален, отрицательный заряд электронных оболочек в атоме нейтрализуется равным по величине положительным зарядом ядра. Поэтому другое представление об атомном номере состоит в том, что атомный номер химического элемента - это положительный заряд ядра его атома, выраженный в величинах элементарных электрических зарядов (то есть в зарядах электрона).
д) Масса покоя одиночного электрона mе = 9.1095.10-28 г, что соответствует приблизительно 5.486.10-4 а.е.м. Разница в порядках величин масс всего атома (от единицы до сотен а.е.м.) и электронов в нём (от 5.486.10-4 до величин порядка 10-2 а.е.м.), которая, как видно из приведенных цифр, составляет четыре порядка, приводит к выводу о том, что практически вся масса атома сосредоточена в его ядре.
е) Размеры атомов, найденные в экспериментах, выполненных по различным методикам, имеют порядок 10-8 см, тогда как размеры их ядер - величины порядка 10-13 см.Эти цифры говорят о том, что ядро занимает ничтожную часть объёма атома.






