Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Криоскопия (от греч. κρύο — холод и греч. σκοπέω смотрю) — метод исследования растворов, в основе которого лежит измерение понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Был предложен Ф. Раулем в 1882 году
. Криоскопия (от крио... и... скопия),метод физико-химического исследования, основанный на измерении понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Согласно Рауля законам, для бесконечно разбавленного раствора (при отсутствии электролитической диссоциации) существует зависимость D tk = Ek×n, где D tk — понижение температуры замерзания раствора, °С; n — концентрация раствора. Коэффициент E k называется криоскопической постоянной растворителя. Значение Ek для различных жидкостей различно: например, для воды оно составляет 1,86, для бензола 5,07, для уксусной кислоты 3,90, для диоксана 4,63, для фенола 7,27. Зная Ek, можно вычислить молекулярную массу М вещества по формуле М=Р1×Ек· 1000 /Р2 D tk, где P1 и P2 — соответственно масса растворённого вещества и растворителя в г. Разность температур D tк измеряют обычно метастатическим термометром или с помощью термопары. Методом К. могут быть определены значения Ek для веществ с известной молекулярной массой, а также концентрация вещества в растворе.
Эбулиоскопия (от лат. ebulio — вскипаю) — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).
Эбулиоскопия
Эбулиоскопия, эбуллиоскопия (от лат. ebullio — вскипаю и...скопия), метод физико-химического исследования, основанный на измерении повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя. Согласно Рауля законам, для бесконечно разбавленного раствора нелетучего вещества и при отсутствииэлектролитической диссоциации это повышение D t kип пропорционально моляльной концентрации т раствора: D t kип = Е э. m, где Е э — коэфф. пропорциональности (эбулиоскопическая постоянная), характерный для каждого растворителя и не зависящий от природы растворённого вещества. Так, Е э для воды равен 0,526, для бензола 2,57, для диоксана 3,27, для камфоры 6,02, для дибромэтана 6,43 (все величины выражены в °С). Э. наряду с криоскопией используется для определения молекулярной массы растворённого вещества, активностей растворителя и растворённого вещества или степени диссоциации слабого электролита. Молекулярную массу М растворённого вещества вычисляют по уравнению:
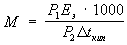
Где P1 и P2— соответственно массы растворённого вещества и растворителя, выраженные в г. Разность температур Dtkип измеряют посредством метастатического термометра или чувствительной термопары.
РАВНОВЕСИЕ В СИСТЕМЕ ОСАДОК - РАСТВОР
Образование осадков
В гравиметрическом анализе необходимо получение чистых и хорошо фильтруемых осадков, т. е. крупнокри-

Рис. VI-1. Зависимость растворимости (5) и пересыщения (Ss) осадков от температуры для сульфата бария (а) и хлорида серебра (б):






