при V= Const и Т= Const
Из объединённого уравнения первого и второго законов термодинамики следует, что
δA ≤ TdS - dU (2.49)
Интегрирование уравнения (2.49) при переходе системы из состояния 1 в состояние 2 при постоянных температуре и объёме даёт:
А ≤ T(S2 – S1) – (U2 – U1) (2.50)
или
A ≤ (U1 – TS1) – (U2 – TS2) (2.51)
Выражение в скобках назвали энергией Гельмгольца
U – TS = F (2.52)
Так как все величины, входящие в уравнение (2.52) являются функциями состояния, то и величина F также будет иметь свойства функции состояния системы. Тогда уравнение (2.51) примет вид:
А ≤ F1 - F2 = - ΔF (2.53)
Из уравнения (2.53) вытекает, что если процесс протекает обратимо при постоянных V и Т, то его работа максимальна и равна убыли энергии Гельмгольца (A  = - ΔF). Для необратимых (самопроизвольных, неравновесных) процессов работа всегда меньше максимальной работы (A < - ΔF).
= - ΔF). Для необратимых (самопроизвольных, неравновесных) процессов работа всегда меньше максимальной работы (A < - ΔF).
Энергия Гельмгольца может служить критерием направления протекания процесса и условия равновесия в системе при V = Const и T = Const. Продифференцируем уравнение (2.53)
dF = dU – TdS – SdT (2.54)
Из объединённого уравнения первого и второго законов термодинамики следует, что
TdS ≥ dU + PdV (2.55)
Подставив уравнение (2.55) в уравнение (2.54), получим:
dF ≤ dU – dU –PdV –SdT (2.56)
или
dF ≤ -PdV – SdT (2.57)
Уравнение (2.57) выражает зависимость изменения энергии Гельмгольца от объёма и температуры. При V = Const и T = Const уравнение принимает вид:
dF ≤ 0 (2.58)
Из уравнения (2.57) вытекает: в системе, находящейся при V = Const и
Т = Соnst, необратимые (самопроизвольные, неравновесные) процессы протекают с уменьшением энергии Гельмгольца (dF <0). По достижении минимального значения энергии Гельмгольца (dF = 0) в системе наступает состояние равновесия (рисунок 2.2)

 F
F
А С
В
 |
путь процесса
AB – необратимый, самопроизвольный процесс;
ВС – необратимый, несамопроизвольный процесс;
В – состояние равновесия
Рисунок 2.2 - Изменение энергии Гельмгольца при протекании
процесса системе при V = Const и T = Const.
Покажем, что функция F является характеристической функцией. Поскольку F является функцией состояния и зависит от объёма и температуры F = f(V,T), то она обладает полным дифференциалом:
dF = 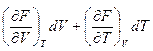 (2.59)
(2.59)
С другой стороны для обратимого процесса зависимость энергии Гельмгольца от объёма и температуры имеет вид:
dF = - PdV – SdT (2.60)
Из свойств полного дифференциала и сравнения уравнений (2.59) и (2.60) следует:
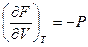 и
и 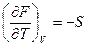 (2.61)
(2.61)
Таким образом частные производные энергии Гельмгольца по объёму и температуре равны параметрам Р и S. Из равенства (2.61) следует, что давление есть мера убыли энергии Гельмгольца при увеличении объёма системы, в которой Т =Const. Энтропия есть мера уменьшения энергии Гельмгольца при увеличении температуры системы, находящейся при постоянном объёме.
2 .9 Энергия Гиббса, как критерий направления протекания






