Третичной структурой белка называется способ укладки в пространстве полипептидной цепи, имеющей определённую вторичную структуру. По форме молекулы и особенностям пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Форма первых близка к сферической или эллипсоидной, с отношением короткой и длинной осей до 1:50. Молекулы фибриллярных белков имеют удлинённую форму (форма нити, палочки) и соотношение осей 1: (75-200).
Третичная структура глобулярных белков стабилизируется в основном за счёт образования ковалентных дисульфидных связей между радикалами цистеина:
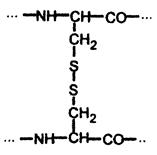
Дополнительный вклад также вносят слабые нековалентные связи: гидрофобные - между неполярными радикалами; водородные - между полярными радикалами; ионные - между заряженными радикалами (рис. 7).

Рис.7. Связи, стабилизирующие третичную структуру белков
Третичная структура белка после его синтеза в рибосомах возникает автоматически и предопределяется первичной структурой белка. Третичная структура глобулярного белка (рис.8а) не является абсолютно жёсткой, в известных пределах возможен разрыв некоторых слабых нековалентных связей и образование новых: глобула как бы пульсирует в растворе.
Структурная организация фибриллярных белков имеет ряд особенностей по сравнению с глобулярными. Фибриллярные белки составляют основную массу соединительной ткани в организме человека и животных. Коллаген - самый распространённый фибриллярный белок, он составляет 1/3 часть от всех белков в организме человека. Эластин, который по сравнению с коллагеном более эластичен, содержится в тканях, испытывающих периодическое растяжение и сокращение: кровеносные сосуды, лёгкие, некоторые связки суставов. α-Кератины входят в состав эпидермиса кожи, волос, ногтей. Фибриллярные белки построены из трёх пептидных цепей (в каждой около 1000 аминокислотных остатков), каждая из которых имеет конформацию спирали, отличную от α-спирали (за исключением α-кератинов). Эти три спирали в молекуле коллагена перевиты друг с другом, образуют плотный жгут за счет водородных связей между цепями и внутри цепей. Молекулы коллагена, соединяясь «бок о бок», образуют микрофибриллы, из последних формируются более толстые - макрофибриллы, а из них - волокна и пучки волокон. Аналогичную структуру имеют α-кератины. В одном волосе, например, содержатся сотни макрофибрилл α-кератина, ориентированных по длине волоса. Фибриллярные белки имеют специфический аминокислотный состав. Например, в коллагене каждая третья аминокислота - глицин, 20%- остатки пролина и гидроксипролина, 10%- аланина и 40%- остальные аминокислоты.
Если первичная структура белков даёт возможность предсказать конформацию молекулы, то есть её вторичную и третичную структуры, то третичная структура содержит информацию иного рода, а именно функциональную. Все биологические свойства белков связаны с сохранностью его третичной структуры, которую называют нативным белком. Любые воздействия, приводящие к нарушению этой конформации, сопровождаются полной или частичной потерей белком его биологических свойств.






