С признанием теории Аррениуса возникла возможность классификации кислот и оснований по характеру их диссоциации в растворах. С этой точки зрения кислотой следует считать электролит, в водном растворе, которого присутствуют гидратированные ионы водорода (ионы гидроксония). Основания в водных растворах отщепляют гидроксид – ион.
Характер кислотно-основного равновесия в неводных растворах имеет свои особенности.
В соответствии с теорией сольвосистем это равновесие должно удовлетворять условию.
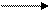 Кислота + основание соль + растворитель.
Кислота + основание соль + растворитель.
Эти представления позволили дать определенную классификацию взаимодействий в неводных растворителях, но такой подход был формальным и теория сольвосистем не получила широкого распространения.
В основу современных теорий кислот и оснований положены представления Бренстеда-Лоури и Льюиса.
По протонной теории кислот и оснований Бренстеда-Лоури, (1923 г.), кислота является донором протона, а основание – акцептором протона. Протон не может существовать в растворе самостоятельно, он должен быть принят основанием, поэтому, чтобы кислота могла отдать протон, необходимо присутствие основания, к которому протон переходит. Возникают кислотно- основные пары, которые называют сопряженными. Следовательно, каждая кислота имеет сопряженное с ней основание и каждое основание - сопряженную с ним кислоту.
Реакция отдачи протона выражается схемой:

 кислота1 основание1 + H+
кислота1 основание1 + H+
Реакция принятия протона выражается схемой:
Основание 2 + H+ = Кислота 2
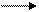 Суммарно: кислота1 + основание 2 кислота 2+ основание 1
Суммарно: кислота1 + основание 2 кислота 2+ основание 1

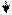

 Например: HCl + NH3 Cl- + NH4+
Например: HCl + NH3 Cl- + NH4+
кислота 1 основание2 основание 1 кислота 2
 HCl Cl- + NH4+
HCl Cl- + NH4+
 кислота 1 основание 1
кислота 1 основание 1

 NH3 + H+ NH4+
NH3 + H+ NH4+
основание2 кислота 2
В приведенном равновесии участвуют две пары кислот и оснований: сопряженными кислотой и основанием являются:
HCl и CL- ; NH4+ и NH3
К кислотам и основаниям по теории Бренстеда-Лоури относятся не только молекулы, но и ионы.
Например, ионы аммония и гидросульфат-ион является кислотами, так как они способны отщеплять протоны:
 NH4+ NH3 + H+
NH4+ NH3 + H+
 HSO4- SO42- + H+
HSO4- SO42- + H+

Ацетат – ион является основанием, так как он принимает протон

 CH3COO- + H+ CH3COOH
CH3COO- + H+ CH3COOH
Одно и тоже вещество при растворении в разных растворителях может проявлять амфотерные свойства, то есть быть кислотой и основанием.
Например, в жидком аммиаке гидросульфид – ион HS- проявляет свойства кислоты:
 HS- + NH3 NH4+ + S 2-
HS- + NH3 NH4+ + S 2-
 кислота основание кислота основание
кислота основание кислота основание
находясь же в бромоводороде HS-, будет основанием:
 HS- + НBr H2S + Br-
HS- + НBr H2S + Br-
основание кислота кислота основание
Во всех этих реакциях протон играет особую роль при взаимодействии кислот и оснований, поэтому, согласно теории Бренстеда-Лоури, кислоты и основания носят общие название – ПРОТОЛИТЫ, а реакции между ними - протолитические.
К протолитическим реакциям относят реакции нейтрализации, гидролиза, диссоциации кислот и оснований.
Например:
- диссоциация кислот:
 |

 NH3 + H2O NH4+ + OH-
NH3 + H2O NH4+ + OH-
основание2 кислота1 кислота 2 основание 1
-диссоциация оснований:
 НSCN + H2O SCN- + H3O+
НSCN + H2O SCN- + H3O+
кислота 1 основание2 основание 1 кислота 2
-гидролиз:

 CH3COONa + HOH CH3COOH + NaOH
CH3COONa + HOH CH3COOH + NaOH
 |

 CH3COO- + H2O CH3COOH + OH-
CH3COO- + H2O CH3COOH + OH-
основание1 кислота2 кислота 1 основание 2
- реакция нейтрализации
 |

 HCl + NaOH NaCl + H2O
HCl + NaOH NaCl + H2O

 H3O+ + OH- H2O + H2O
H3O+ + OH- H2O + H2O
кислота 1 основание 2 кислота 2 основание 1
Механизм этих реакций один и тот же – в реакциях происходит перемещение протона от одних молекул или ионов к другим молекулам или ионом.
Протонная теория кислот и оснований Бренстеда-Лоури позволила достаточно четко разграничить эти два класса веществ и сделать целый ряд количественных выводов, касающихся характера кислотно-основного равновесия. Однако существуют вещества, которые обладают сильно выраженными кислотными и основными свойствами, но не могут быть отнесены к кислотам и основаниям из-за отсутствия протона по теории Бренстеда-Лоури. К числу таких веществ относятся, в частности, галогениды бора, алюминия, кремния, олова, обладающие кислотными свойствами.
Согласно электронной теории кислот и оснований Льюиса, кислота –акцептор электронной пары, а основание – донор.
Взаимодействие между кислотой и основанием с этой точки зрения заключается в возникновении ковалентной связи по донорно-акцепторному механизму:
F H F H
........

 F:B +: N:Н F:B: N:H
F:B +: N:Н F:B: N:H
........
F H F H
Здесь донором электронной пары, т.е. основанием по Льюису, является аммиак, а в качестве кислоты выступает акцептор BF3
Протонная теория кислот и оснований Бренстеда-Лоури и электронная теория Льюиса дополняют друг друга и имеют глубокую внутреннюю связь. В определенном смысле кислоты, по Бренстеда-Лоури, представляют собой частный случай льнеисовских, поскольку протон характеризуется большим сродством к электронной паре и, по Льюису, может рассматриваться как сильная кислота.
Таким образом, общее свойство кислот и оснований, по Льюису и Бренстеду-Лоури, - способность к взаимной нейтрализации с образованием стабильных ковалентно – насыщенных соединений.
Вопросы для самоконтроля
1. Дать понятие: электролиты и неэлектролиты.
2. Сформулировать основные положения ТЭД.
3. Показать механизм ЭД на примере хлорида натрия.
4. Что называется степенью диссоциации?
5. Что называется константой диссоциации?
6. Как измениться степень диссоциации цеановодородной кислоты, если к раствору прибавить ее соль – цианид натрия?
7. Как измениться степень диссоциации гидрата аммиака, если к его раствору добавить нитрат аммония?
8. Что называется кислотой по теории Бренстеда-Лоури?
9. Что называется основанием Бренстеда-Лоури?
Лекция №12
Тема: Ионные реакции обмена. Гидролиз солей.
План
1. Химические реакции между электролитами.
2. Вода как слабый электролит. Понятие о рН растворов.
3. Гидролиз солей.
а) Понятие гидролиза и его значение.
б) Гидролиз соли, образованный катионом сильного основания и анионом
слабой кислоты
в) Гидролиз соли, образованный катионом слабого основания и анионом
сильной кислоты
г) Гидролиз соли образованный катионом слабого основания и анионом
слабой кислоты
д) Гидролиз соли образованный катионом сильного основания и анионом
сильной кислоты
е) Ступенчатый гидролиз
ж) Необратимый или полный гидролиз
1. Химические реакции между электролитами.
Многие химические реакции протекают в вводных растворах. Электролиты в водных растворах находятся в диссоциированном состоянии, т.е. или только в виде ионов (сильные электролиты) и частично в виде молекул (слабые электролиты). Следовательно, реакции между водными растворами электролитов - это реакции, в которых участвуют ионы. Взаимодействие ионов в растворе называется ионной реакцией.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Эти реакции возможны только в том случае, если между ионами происходит химическое взаимодействие, т.е. какие либо ионы одного электролита и какие либо ионы другого электролита связываются друг с другом и образуют:
— Нерастворимое вещество;
— Газообразное вещество;
— Малодиссоциирующие вещества (слабый электролит);
— Комплексные соединения.
Ионное уравнение составляют в определенной последовательности:
— Пишут в ионном виде формулы диссоциирующих исходных веществ и в молекулярном - недиссоциирующих;
— То же правило соблюдается и для продуктов реакции;
— Проверяют, совпадают ли друг с другом по абсолютной величине суммы положительных и отрицательных зарядов ионов в левой части равенства, а затем в правой;
— Проверяют, совпадает ли число одноименных ионов в левой и правой частях равенства, учитывая атомы, входящие в состав недиссоциирующего вещества;
— Для составления сокращенного ионного уравнения исключают одноименные ионы из правой и левой частей уравнения, а затем записывают полученное сокращенное ионное уравнение, которое выражает сущность реакции.
Пример; написать уравнение реакции взаимодействия растворов хлорида бария и сульфата натрия в молекулярной, ионной и сокращенной ионной формах:
1. Записываем уравнение реакции в молекулярной форме:
ВаС12 + Na2SO4 = BaSO4↓ + 2NaCl
2. Переписываем это уравнение в виде ионов (диссоциирующие вещества) и
в виде молекул (вещества, уходящие из сферы реакции):
Ва2+ + 2С1 - + 2Na+ + SO42- = BaSO4 ↓ + 2Na+ + 2Сl - полное ионное уравнение
3. Исключаем из обеих частей равенство одинаковые ионы, т.е. не
участвующие в реакции:

|
4. Выписываем уравнение реакции в окончательном виде:
Ва2+ + SO42- = BaSO4 ↓
сокращенное ионное
Сущность данной реакции - взаимодействии ионов Ва 2+ и SO4 2- с образованием осадка BaSO4.
Многочисленные реакции обмена в растворах электролитов могут быть обратимыми или необратимыми. Необратимые реакции характеризуются:
— Образованием осадка
AgNO3 + HC1 = AgCl↓ + HNO3
Ag+ + NO-3 + Н+ + Cl - = AgCl + H+ + NO-3
Ag+ + CI- = AgCl ↓
— Образованием газообразных малорастворимых веществ
Na2CO3 + H2SO4 = Na2SO4 + СO2↑ + Н2O
2Na+ + CO2-+ 2Н+ + SO2-4 = 2Na+ + SO2-4 = 2Na+ + SO2-4 + CO2↑ + H2O
CO2-3 + 2H+ = СO2↑ + H2O
— Образованием малодиссоциирующих веществ (слабых электролитов)
НСl + КОН = КС1 + Н2O
Н+ + Сl - + К+ + ОН - = К+ + С1- + Н2O
Н+ + ОН- = Н2O
— Образованием комплексных соединений (ионов)
CuSO4 • 5Н2O + 4NH3 = [Cu(NH3)4]SO4 + 5H2O-
[Cu(NH3)4]2+ + SO2-4 + 5Н2O +4NH3 = [Cu(NH3)4]2+ + SO2-4 + BaSO4 + 5H2O
[Cu(NH3)4]2+ + 4NH3 = [Cu(NH3)4]2+ + H2O
Если в результате реакции образуется оба хорошо диссоциирующие вещества, реакция не протекает, т.к. никаких изменений с ионами не происходит:
2КС1 + Na2SO4 ≠ 2NaCl + K2SO4
2К+ + 2Сl- + 2Na+ SO2-4 ≠2Na+ + 2СГ + 2К+ SO2-4
2. Вода как слабый электролит. Понятие о рН растворов.
Вода как слабый электролит в малой степени диссоциирует на ионы, которые
находятся в равновесии с недиссоциированными молекулами:

 Н2O H++ ОН –
Н2O H++ ОН –
концентрации ионов [Н+] и [ОН-] одинаковы. Опытным путем установлено, что в 1 л воды при t° = 22 °С диссоциации подвергаются лишь 10-7 моль и при этом
образуется 10 -7 моль/л ионов Н+ и 10 -7 моль/л ионов ОН-.
Произведение концентраций [Н+] и [ОН-] в воде называется ионным произведением воды (Кв). При t° = 22 °С численное значение Кв равно 10-14, это величина постоянная.
Кв = [Н+] ∙ [ОН-] = 10 -7 ∙ 10-7 = 10-14
Постоянство произведения [Н+] и [ОН-] означает, что в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксид - ионов не может быть равна нулю. Для чистой воды [Н+] = [ОН-] = 10-7 моль/л. Из постоянства произведения [Н+] и [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять [Н+], если известные [ОН-] и наоборот. Например, если в водном растворе [Н+] = 10-3 моль/л, то
[ОН-] = Кв: [Н+] = 10-14: 10-3 = 10-11 моль/л, следовательно кислотность и щелочность раствора можно выразить через [H+] либо [ОН-]. Для кислого раствора [Н+] > 10-7 и для щелочного [Н+]<10-7 моль/л.
Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН («пэ - аш»). Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов: рН = - lg[H+], где [Н+] концентрация ионов водорода, моль/л. С помощью рН реакция растворов характеризуется следующим образом: нейтральная рН = 7, кислая рН < 7, щелочная рН > 7. Чем меньше рН, тем больше концентрация ионов Н+, т.е. выше кислотность среды; чем больше рН, тем меньше концентрация ионов Н+, т.е. выше щелочность среды.
Качественно реакцию среды и рН водных растворов электронов определяют с помощью индикаторов, меняющих свою окраску в определенном интервале рН.
Индикаторами называют вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора, т.е. рН раствора.
Индикаторный метод основан на сравнении окраски индикатора в испытуемом водном растворе с окраской его в условиях известной величины
рН.
Цвета индикаторов в различных средах
| Индикаторы | Среда раствора | ||
| Кислая рН<7 | Нейтральная рН = 7 | Щелочная рН>7 | |
| Метилоранж | Красный | Оранжевый | Желтый |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
3. Гидролиз солей.
а) понятие гидролиза и его значение
Гидролизом соли называется взаимодействие ионов соли с ионами воды, которое приводит к образованию слабых электролитов.
Вода является слабым электролитом и диссоциирует по уравнению
Н2O→Н++ОН-
В результате гидролиза солей их водные растворы показывают, кислую, щелочную или нейтральную реакцию среды. Реакция среды зависит от концентрации ионов водорода Н+ или гидроксид-ионов ОН".
Появление избытка ионов Н+ или ОН" в растворе объясняется тем, что
ионы соли реагируют с ионами воды. Равновесие диссоциации воды
смещается вправо, так как при гидролизе солей образуются слабые электролиты.
NH4C1→NH4+ + С- CH3COONa →СН3СОО- + Na+
Н2O→ОН- + Н+ Н2O →Н+ + ОН-
← ↑ ↓ ← ↑↓
NH4OH CH3COOH
В зависимости от природы соли в растворе накапливаются либо ионы Н+, либо ОН-, которые и определяют реакцию среды.
Гидролиз соли - это реакция, обратная реакции нейтрализации, поэтому каждую соль можно представить себе как соединение, образованное основанием и кислотой. Кислоты и основания бывают сильными и слабыми электролитами. В зависимости от силы исходной кислоты и исходного основания различают четыре типа солей:
. образованные сильным основанием и слабой кислотой;
. образованные слабым основанием и сильной кислотой;
. образованные слабым основанием и слабой кислотой;
. образованные сильным основанием и сильной кислотой.
б) гидролиз соли, образованной катионом сильного основания и анионом слабой кислоты
В водном растворе цианида калия соль полностью распадается на ионы калия К+ и цианид - ионы CN-. Ионы калия К+ и гидроксид-ионы ОН- могут находиться в растворе одновременно в значительных количествах. Ионы водорода Н+ и цианид - ионы CN- взаимодействуют между собой с образованием цианидводородной кислоты (Kq = 6,0 г х 10-10)
KCN→К+ + CN-
Н2O→ ОН-+ Н+
← ↓↑
HCN
В результате гидролиза такой соли в растворе находятся полностью продиссоциированная щелочь и слабо диссоциированная кислота. Эта кислота частично диссоциирует на ионы и возвращает в раствор часть ионов Н+ и CN". Возникает обратная реакция и устанавливается динамическое химическое равновесие.

 К+ + CN- + Н2O К+ + ОН- + HCN
К+ + CN- + Н2O К+ + ОН- + HCN
Следовательно, реакция между цианидом калия и водой является обратимой и проходит не полностью. Такое явление называется обратимым гидролизом.
В результате того, что в растворе образуется сильный электролит гидроксид калия, концентрация гидроксид-ионов ОН- будет значительно больше концентрации ионов водорода Н+. В растворе соли возникает щелочная среда, т.е. рН > 7. Эксперимент показывает, что 0,1М раствор этой соли имеет рН 11,
1. Гидролиз цианида калия в сокращенной ионной форме:

 CN- + Н2O ОН+ +HCN
CN- + Н2O ОН+ +HCN
Гидролиз соли, образованной катионом сильного основания и анионом слабой кислоты, идет по аниону слабой кислоты, и реакция среды становится щелочной.
в) гидролиз соли, образованной катионом слабого основания и анионом
сильной кислоты
Рассмотрим гидролиз соли - йодид аммония NH4J. При растворении этой соли в воде катион аммония связывает гидроксид-ион ОН- воды и ионы водорода накапливаются в растворе:

 NHJ + Н2O NH4OH + HJ
NHJ + Н2O NH4OH + HJ

 NH4+ + Н2O NH4OH + Н+
NH4+ + Н2O NH4OH + Н+
В результате гидролиза данной соли в растворе образуются слабое основание NH4OH и сильная кислота HJ. Йодоводородная кислота является сильным электролитом и в водном растворе полностью распадается на ионы. Концентрация ионов водорода становится значительно больше, чем концентрация гидроксид-ионов, и раствор соли имеет, кислую среду, т.е. рН <7. Таким образом, гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты, идет по катиону слабого основания, и реакция среды становится кислой.
г) гидролиз соли, образованной катионом слабого основания и анионом слабой
кислоты
В случае гидролиза солей, образованных катионом слабого основания и анионом слабой кислоты, оба иона ОН- и Н+ воды связываются с образованием слабой кислоты и слабого основания.

 СН3 COONH4 → CH3COO- + NH4+ Н2O Н+ +ОН-
СН3 COONH4 → CH3COO- + NH4+ Н2O Н+ +ОН-
↓ ↑ ↑ ↓
СН3СООН NH4OH
Гидролиз соли идет одновременно и по катиону и по аниону. В зависимости от константы диссоциации продуктов гидролиза (кислоты и основания) реакция среды растворов таких солей может быть слабокислой, слабощелочной или нейтральной. Реакция среды в случае гидролиза ацетата аммония CH3COONH4 - нейтральная, поскольку константы диссоциации СН3СООН и NH4OH равны.
Таким образом, гидролиз соли, образованной катионом слабого основания и анионом слабой кислоты, идет одновременно и по катиону и по аниону. Реакция среды зависит от констант диссоциации продуктов гидролиза.
д) гидролиз соли, образованной катионом сильного основания и анионом
сильной кислоты
Соли этого типа гидролизу не подвергаются, потому что катионы и анионы этих солей не связываются с ионами Н+ и ОН", воды и в растворе не образуются молекулы слабых электролитов, поскольку связывания ионов воды не происходит, реакция среды растворов этих солей остается нейтральной.

 NaCl + Н2O NaOH + HC1
NaCl + Н2O NaOH + HC1

 Na+ + С1- + H2ONa+ + ОН" + Н+ + С1-
Na+ + С1- + H2ONa+ + ОН" + Н+ + С1-

 Н2O Н+ + ОН-
Н2O Н+ + ОН-
Ионы соли не участвуют в реакции и среда остается нейтральной. Следовательно, соли, образованные катионом сильного основания и анионом сильной кислоты, при растворении в воде гидролизу не подвергаются, а реакция среды остается нейтральной.
е) ступенчатый гидролиз
Гидролиз соли, образованной анионом многоосновной кислоты или катионом слабого многокислотного основания протекает ступенчато. Число ступеней гидролиза зависит от основности слабой кислоты и кислотности слабого основания.
Рассмотрим гидролиз соли, образованной катионом сильного основания и анионом слабой многоосновной кислоты. На первой ступени гидролиза этой соли образуется кислая соль вместо кислоты и сильное основание.

 Первая ступень: Na2CO3 + H2O NaHCO3 + NaOH
Первая ступень: Na2CO3 + H2O NaHCO3 + NaOH
C032-+H2O →НСO3-+ ОН
Вторая ступень: NaHCO3 + H2O→H2CO3 + NaOH
 НСО3- +Н2O Н2СO3 + ОН-
НСО3- +Н2O Н2СO3 + ОН-
Гидролиз протекает по аниону. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени. Среда раствора соли карбоната натрия - щелочная (рН>7), так как в растворе увеличивается концентрация гидроксид-ионов ОН-.
Гидролиз соли, образованной катионом слабого многокислотного основания и анионом сильной кислоты. В водных растворах таких солей на первой ступени образуется основная соль вместо основания и сильная кислота.






