Независимо от того, какие (по точности) приготовляют растворы, применять следует только чистые растворители. Если растворителем служит вода, то можно применять только дистиллированную или деминерализованную воду, а в отдельных случаях даже бндистиллят или специально очищенную дистиллированную воду.
Предварительно подготавливают соответствующей емкости посуду (см. ниже), в которой будут готовить и хранить получаемый раствор. Посуда должна быть чистой. Если есть опасение, что водный раствор может взаимодействовать с материалом посуды, то посуду внутри следует покрыть церезином, парафином или другими химически стойкими веществами.
Пример. Если нужно приготовить 1 л какого-то раствора, то для растворения следует взять посуду емкостью не больше 1,5 л. Если готовят 10 л раствора, то бутыль должна быть емкостью не больше 12—13 л.
Перед приготовлением растворов нужно подготовить по возможности два одинаковых сосуда: один — для растворения, а другой — для хранения раствора.. Может случиться, что раствор нужно будет отфильтровывать от какого-либо осадка или примеси, не растворившейся в данных условиях.
Вымытый сосуд полезно предварительно проградуиро-вать (рис. 347). Это особенно касается бутылей большой емкости. Градуирование проводят следующим образом: мерным цилиндром отмеривают 1 л воды и переливают ее в бутыль. На стенке бутыли восковым карандашом про-
|

|
| C-C |
водят черту, совпадающую с уровнем воды в бутыли, й ставят цифру 1. Затем наливают второй литр воды и уровень отмечают цифрой 2. Так проделывают до тех пор, пока бутыль не будет заполнена до плеча. Расстояние между цифрами, обозначающими целые литры, можно разделить пополам более короткой чертой. Каждая такая черта будет соответствовать 0,5 л.
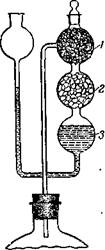
| Рис. 348. Приспособление для хранения растворов в атмосфере двуокиси углерода: / — стеклянное волокно; 2 — мрамор; S — раствор соляной кислоты. |
Рис 347. Градуированная бутыль.
Для растворения следует применять по возможности чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют растворы, т. е. добавляют в них недостающее количество вещества или воды.
Нужно принимать меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Так, щелочи следует защищать от двуокиси углерода, для этого бутыль с щелочью снабжают хлор кальциевой трубкой, заполненной натронной щелочью или аскаритом.
Как во время приготовления растворов, так и при их хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками.
При особо точных~и ответственных анализах следует обязательно принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду или такую, стекло которой не содержало бы искомый элемент. Так, неизбежна ошибка при определении бора, цинка, алюминия, свинца и некоторых других элементов в посуде из стекла, содержащего эти элементы.
В некоторых случаях растворы следует хранить в атмосфере инертного газа, как азот, или в атмосфере двуокиси углерода. Для этого существуют специальные устройства или особые бюретки, приспособленные для каждого случая титрования.
Для хранения растворов в атмосфере двуокиси углерода в бутыль с раствором вставляют на пробке прибор, изображенный на рис. 348. В среднюю, расширенную, часть его насыпают куски мрамора среднего размера (как для аппарата Киппа), верхний шар заполняют стеклянным волокном. Через боковую воронку в прибор наливают раствор соляной кислоты, разбавленной 1: 2. Если из бутыли через тубус выливать жидкость, то над уровнем жидкости Создается вакуум, и раствор соляной кислоты перемещается в средний шар. В результате начинается реакция с мрамором и образовавшаяся двуокись углерода поступает в бутыль. Когда в бутыли создается небольшое давление, соляная кислота переместится в нижний шар и выделение газа прекратится.
Щелочные растворы нельзя оставлять надолго в фарфоровой и особенно — в стеклянной посуде. Если приходится их оставлять, то необходимо вначале нейтрализовать растворы, потом немного подкислить и хранить только подкисленные растворы. При этом растворы лучше оставлять в фарфоровой посуде, а не в стеклянной.
Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные массы элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомную массу железа можно принять равной 56 вместо точной — 55,847; для серы — 32 вместо точной 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого иатрия; предварительно вычисляем требуемое количество соли. Расчет проводится согласно пропорции:
100—15 15 1500
,500-, Х~—Ш- ~225 г
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды нужно взять 1500—225=1275 г.
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-ного раствора хлористого натрия при 15 °С равна 1,184 г/смг. Следовательно, 1500 мл составляет:
1500-1,184= 1776 г т. е.
100—15 15-1776
i776_, *=—ioo—=266-4 *
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SCv 10H2O, то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора l'.*aj!S04, исходя из NasSCvlOHaO.
Молекулярная масса Na2S04 равна 142,041, a Na2S04-10Н2О-322.195, или округленно 322,20.
Расчет ведут вначале на безводную соль:
100—10 10-2000
2000-* х = —joo—= 200а
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят нз расчета:
142.04 — 322,2 200-322.2
200 —х 1*2,04
Воды в этом случае нужно взять: 2000—453,7 = 1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2S04 или 25%-ный Na2S04- 10H2O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так,чтобы получить 2 л 5%-ного раствора. Расчет ведем следующим путем.
По справочнику узнаем, что плотность 5%-ного раствора (NH4)-2S04 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287-2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
100 — 5 5-2057.4 ino o„
х =------ tkf. — = 102,87 г
2057,4 — х 10°
Теперь можно подсчитать, сколько нужно взять 20%-ного раствора, чтобы получить 2 л 5%-ного раствора. Составляем пропорцию:
ЮО — 20 100-102,87
| X! |
= 514,35 г
х — 102,87
Полученную массу раствора можно пересчитать на объем ero.j Для этого массу раствора делят на его плотность (плотность] 20%-ного раствора равна 1,1149 г/см3), т. е.
514,35,„, п
\ = 461,3 мл
1,1149"
Учитывая, что при отмеривании могут произойти потери, нуж(но взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000 — 462 = 1538 мл воды.
,
Если же разбавление проводить по массе, расчет упро щается. Но вообще разбавление проводят из расчета пЛ объем, так как жидкости, особенно в больших количеси вах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с раств«я рением, так и с разбавлением никогда не следует выли вать сразу всю воду в сосуд. Водой ополаскивают несколь|
ко раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5 — требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
20ч „5 С"5ч45
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
35ч „10
*25\ \f/ Ч10
т.' е. нужно взять по 10 объемов обоих растворов.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.
Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы,
Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть а — количество раствора, т% — концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а-т
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей т%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
п (I — т) х ^ п — I
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проводят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения.
При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз
38?
небольшими порциями воды обмывают над воронкой бюкс или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
|
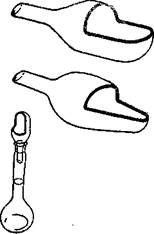
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6 и 10 еж3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
| Рис. 349. Вороики для пересыпания навески в колбу. |
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 М раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 М раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgN03, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 М), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствующем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или деци-нормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут Vio или V4 того количества вещества, которое требуется для приготовления 1 л, и растворяют в соответствующем объеме воды.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности,: которая задана. В таких случаях иногда вводят поправку.,
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквива-, ленту растворяемого вещества, пользуясь формулой:
Эр Г V
Э0 1000
где а — количество растворяемого вещества, г;
Эр — величина грамм-эквивалента растворяемого вещества, г; Т — титр раствора по определяемому веществу, г/мл; V — заданный объем раствора, мл; Э0 — величина грамм-эквивалента определяемого вещества, г.
Пример. Пусть нужно приготовить 3 л раствора марганцево-" кислого калия с титром по железу 0,0050 г/мл. Грамм-эквиваленте КМп04 равен 31,61, а грамм-эквивалент Fe — 55,847.
Вычисляем по приведенной выше формуле:
31,61 0,0050-3000
° =---------- 55-817-------- =8,4901 г
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями^
применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометриче-ских определениях и пр. Иногда стандартные растворы хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением.
Стандартные растворы готовят в объеме не больше 1 л, а чаще — меньше. Только при большом расходе стандартного раствора можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
| а = |
Мх Т V
М2(А)
где Мх — молекулярный вес растворяемого вещества;
Т — титр раствора по определяемому веществу, г/мл; V — заданный объем, мл; М2(А) — молекулярный или атомный вес определяемого вещества.
Пример. Нужно приготовить стандартные растворы CuS04-5H20 для колориметрического- определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего — 0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Мг == 249,68; А^ — 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
249,68-0,001-100
а **---------- 63~54-------- -= 0,3929 г CuS04 ■ 5Н20
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл.
Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuS04, содержащего Си 10 мг/мл. Для приготовления раствора применяют CuS04-5H20.
25-117
Чтобы подсчитать, сколько следует взять этой соли для приготовления раствора заданного объема, подсчитывают, сколько Си должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500 ■ 10 = 5000 мг, или 5,0000 г
После этого, зная молекулярную массу соли, подсчитывают нужное количество ее:
249,68 — 63,54 ' 249,68-5 „ „
или Л' = —со с.— = 19,648 г
х — 5,0000 63,54
На аналитических весах отвешивают в бюксе точно 19,648 г истой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
Растворы солей
Приблизительные растворы. Растворы солей готовят, как указано выше. Готовый раствор или отфильтровывают, или дают ему отстояться от нерастворимых в воде примесей, после чего при помощи сифона отделяют прозрачный раствор. Полезно проверить концентрацию каждого приготовленного приблизительного раствора. Это легче всего сделать, измерив ареометром плотность и сравнив полученную величину с табличными данными, которые можно найти в справочнике. При большом расхождении табличных данных с полученным результатом измерения последнее повторяют еще раз, и если будет получено снова то же значение, что и при первой проверке, раствор можно «поправить». Если раствор имеет концентрацию меньше аданной, к нему добавляют нужное количество растворяемого твердого вещества. Если же раствор имеет концентрацию больше заданной — добавляют воду и доводят концентрацию до требуемой.
Точные растворы. Точные растворы солей чаще всего готовят для аналитических целей, причем обычно нормальной концентрации. Примеры расчетов для таких случаев приведены выше.
Следует отметить, что некоторые из точных растворов недостаточно стойки при хранении и могут изменяться под действием света или кислорода воздуха, или других, • преимущественно органических, примесей, содержащихся в воздухе. Такие точные растворы периодически прове- • ряют.
Например, в точном растворе серноватистокислого натрия при стоянии часто наблюдается выпадение хлопьев серы. Это является результатом жизнедеятельности особого рода бактерий. Растворы марганцевокислого калия изменяются при действии на них света, пыли и примесей органического происхождения. Растворы азотнокислого серебра разрушаются при действии света. Поэтому большие запасы точных растворов солей, нестойких к хранению, иметь не следует. Растворы таких солей хранят с соблюдением известных мер предосторожности.
От действия света изменяются растворы AgN03, KSCN, NH4SCN, Kl, Ia, Hgl2, KMn04, K2Cr307. Ks[Fe(CN)G] и др.
Растворы щелочей
Приблизительные растворы. Наиболее употребительными растворами щелочей в лабораторной практике являются растворы едкого натра NaOH. Растворы едкого кали КОН готовят редко, растворы же аммиака почти всегда покупают готовыми.
Едкий натр (или едкое кали) имеется в продаже в виде препаратов: технического, чистого и химически чистого. Разница между ними состоит в процентном содержании NaOH (или КОН), а следовательно, и примесей. Технический* NaOH содержит значительные количества NaCl, Na2C03, Na2Si03, Fe203 и т. д. Чистый реактив содержит минимальное количество этих примесей, а Химически чистый реактив содержит только следы их.
Технический едкий натр продают отлитым в железные бочки, чистый — пластинчатыми кусками, а химически чистый — в виде палочек или таблеток.
При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать стеклянной палочкой.
Применять стеклянную посуду при растворении щелочи не рекомендуется, потому что она может легко разбиться и работающий может пострадать, так как концентрированный раствор щелочи разъедает кожу, обувь и одеж-
* В технике едкий натр часто называют каустической содой.
25* 387
ду. Если приходится готовить малые количества щелочи, то можно растворять ее и в стеклянной посуде.
Куски щелочи голыми руками брать нельзя, их следует брать тигельными щипцами, специальным пинцетом или в крайнем случае руками, но обязательно в резиновых перчатках.
Вначале рекомендуется готовить концентрированные растворы щелочи плотности 1,35—1,45 г/см3, т. е. 32— 40%-ные. В подобных концентрированных растворах щелочи многие примеси не растворяются и при отстаивании раствора оседают на дно. Отстаивание концентрированного раствора щелочи продолжается несколько дней (не меньше двух)*. Отстоявшийся раствор осторожно сливают, лучше всего сифоном, в другой сосуд, а осадок выбрасывают или употребляют для мытья посуды.
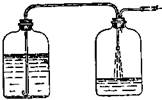
Если в лаборатории приходится часто и в больших количествах готовить растворы щелочи, то применяют следующий прием. Сначала полностью растворяют щелочь в фарфоровой чашке, и когда раствор немного остынет (до 40—50 °С), его через воронку сливают в стеклянную бутыль подходящей емкости. Бутыль хорошо закрывают резиновой пробкой, снабженной отверстием, в которое вставляют хлоркальциевую трубку, наполненную натрон- *" ной известью (для поглощения двуокиси углерода). Когда щелочь отстоится и на дне образуется резко отграниченный слой осадка (в 1—2 см от дна), верхний слой раствора сливают в другую бутыль. В резиновую пробку последней вставляют две трубки, одна из которых должна входить приблизительно на 1/3 высоты бутыли, а другая должна быть на 1—2 см ниже пробки (рис. 350).
На наружный конец длинной стеклянной трубки наса
живают резиновую трубку со стеклянным концом, кото
рый опускают в бутыль с отстоявшейся щелочью. Нижний
конец этой трубки следует изогнуть так, как показано
на рис. 350. Такой конец препятствует захвату осадка
со дна бутыли даже в том случае, если конец трубки кос
нется осадка. Короткую трубку соединяют с вакуум-на
сосом. Включив насос, отстоявшийся раствор быстро И
безопасно перекачивают в другую бутыль. При перелива
нии щелочи нужно следить, чтобы трубка, опущенная
__________
* Естественно, что раствор едкого натра должен отстаиваться беа доступа к нему двуокиси углерода.
«,„ г отстоявшейся щелочью, не поднимала осадок В С°7ДШэ?омуее^ начале переливания держат досгаточ-ГоС"око0на°дТадком, постепенно опуская к концу пере-
ЛИВПпслё этого определяют ареометром плотность рас-
пп тяблиие находят процентное содержание ще-
ТВ°Ра Рели нужно приготевитГ более разбавленный рас-
тЛв°оТ;тоСразбаУвлениеРп;оводят, применяя описанные выше
|
СПХбнцеРнтрирТованные растворы щелочей сильно выще-. лачивают стекло бутылей, поэтому внутренняя часть бу-
Рис 350 Приспособление для перекачивания отстоявшихся растворов.
тыли должна быть покрыта парафином или смесью церезина и вазелина или же сплавом парафина с полиэтиле-
„V«гп Я «Пообки и обращение с ними»). НОМД(ля' покрыт^ стенок бу'тыли парафином несколько кусков е?о помещают внутрь бутыли и последнюю нагре-Гв сушильное шкафу^ или же «ад электрическое^плитой или газовой горелкой (осторожно) до 60-80 С.^ Когда парафин расплавится, бутыль ™™Va™l™"J*™^l ляют расплавленную массу тонким слоем по всей внутрен
"ХТновый или церезиновый слой можно нанес™
пгшменяя паствой этих веществ в авиационном бензине.
ПРтр^иРнТна°чРале растворяют в бензине полута™
раствор -ива-в ^ ='
оси в горизонтальном положении. Когда на ^ewjeoopa зуется парафиновая пленка, бутыль иЦ^мютавд^ /о полного вытеснения паров бензина. Затем бутыль один два раза споласкивают водой. Только после этого ее мож но заполнять щелочью или другой жидкостью.
Обработка бутылей для хранения щелочей особенно важна для аналитических лабораторий, так как предотвращает загрязнение титрованных растворов продуктами выщелачивания стекла.
Точные растворы. Приготовление точных растворов отличается тем, что для них берут химически чистую щелочь, растворяют ее, как указано выше, и определяют содержание щелочи титрованием точным раствором кислоты.
Титр раствора щелочи (т. е. точную концентрацию раствора) лучше всего устанавливать по раствору щавелевой кислоты (С3Н2О4-2Н20)*.
Продажную щавелевую кислоту следует один-два раза перекристаллизовывать и только после этого применять для приготовления точного раствора. Это двухосновная кислота, и следовательно, ее эквивалентная масса равна половине молекулярной. Так как последняя равна 126,0665 то эквивалентная масса ее будет:
126,0665
----- 7j----- = 63,0333
Приготовляя 0,1 н. раствор NaOH, мы должны иметь
раствор щавелевой кислоты такой же нормальности, для
чего на 1 л раствора ее нужно взять:
63,0333
----- jq---- = 6,3033 г
Но для установки титра такое количество раствора не нужно; достаточно приготовить 100 мл или максимум 250 мл. Для этого на аналитических весах отвешивают около 0,63 г (для 100 мл) перекристаллизованной щавеле-
* Так как едкий натр легко поглощает двуокись углерода, то в щелочи всегда присутствует углекислый натрий. Приготовив раствор едкого натра, обязательно устанавливают его концентрацию путем титрования растворов точных навесок органической кислоты, как, например, щавелевая, яблочная и др. Поэтому нет необходимости разбавлять концентрированный раствор в мерной' колбе с доведением уровня раствора точно до метки; можно, перелив его в ту бутыль, где он будет храниться, добавить воду мерным цилиндром. Следует иметь в виду, что при приготовлении растворов едких щелочей основное внимание должно быть уделено защите растворов от двуокиси углерода воздуха. Всякое сокращение операций, при которых раствор может соприкасаться с воздухом, весьма желательно.
вой кислоты с точностью до четвертого десятичного знака.
Начинающие работники при взятии навесок для установки титра часто стараются отвесить точно указанное в руководстве количество вещества (в нашем случае 0,6303 г). Этого делать ни в коем случае не надо, так как такое отвешивание неминуемо требует многократных от-сыпаний и досыпаний вещества в тару. В результате часть вещества попадает на чашки весов и на наружную стенку тары и точно отвешенное количество вещества не удастся полностью перенести в мерную колбу. Поэтому приготовленный раствор будет неточным. Наконец, очень многие вещества изменяются на воздухе (теряют кристаллизационную воду или, как говорят, «выветриваются», поглощают из воздуха двуокись углерода и т. д.). Следовательно, чем дольше продолжается взвешивание, тем больше возможность загрязнения вещества. Поэтому сначала на технохимических весах берут навеску, сходящуюся с требуемой в двух первых десятичных знаках, а затем на аналитических весах определяют точную массу. Навеску растворяют в соответствующем объеме растворителя.
Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в нашем случае будет равна не 0,1 н., а немного меньше. При таком способе несколько усложняется расчет, но достигается большая точность и значительная экономия времени.
Когда раствор будет готов, берут из него пипеткой 20 мл, переносят в коническую колбу, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пример. На титрование израсходовано 22,05 мл раствора щелочи. Вычислить его титр и нормальность.
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, концентрация раствора ее не точно 0,1 н., а равна
0,6223-10 63,03 -0,09873 и.
Чтобы вычислить нормальность раствора щелочи, следует воспользоваться соотношением Nx-Vi = Af2-V2, T- e- произведение объема на нормальность известного раствора равно произведению
объема на нормальность неизвестного раствора. В нашем случав известным является раствор щавелевой кислоты, следовательиЯ
200,09873 = 22,05-х
или
20-0,09873
х = ------ 22~05----- = 0.08955 н.
Нормальность раствора щелочи равна 0,08955.
Чтобы вычислить титр, или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквиз валент щелочи и полученное произведение разделить н| 1000. Тогда титр раствора щелочи будет:
0,08955-40
----- J0QQ---- я. 0,003582 г/мл
В тех случаях, когда Требуются особо чистые растворы едкого натра, их готовят или из спиртовых растворов NaOH, или из амальгамы натрия.
Металлический натрий растворяют в максимально
обезвоженном этиловом спирте. Спиртовый раствор готш
вят приблизительно 5%-ным. Небольшой стакан, напол!
ненный до половины и не больше чем на 3/4 его объема
чистым керосином или лигроином, тарируют на техно!
химических весах дробью или гирьками. Из банки, в
которой хранится металлический натрий под керосинов
или лигроином, берут пинцетом или ножом кусочки
натрия и, обрезав наружные корки ножом, перенося»
в тарированный стакан, отвешивая нужное количеством
При этой операции гири и тару ставят на л е в у ю чаш§
ку весов, а стакан с керосином — на правую чашку*
Иногда вместо металлического натрия применяют"
металлический калий или растворяют в спирте гидроокиси
натрия или калия.
Следует помнить, что растворимость при 28 °С в этЛ ловом спирте NaOH меньше, чем растворимость KOHJj почти вдвое (соответственно 14,7 г/100 г и 27,9 г/100 г).-- Спиртовые растворы щелочей обычно имеют слабо-; желтую окраску, вызываемую осмолением при действии щелочи на примеси, особенно непредельных соединений^ которые могут присутствовать в спирте.
Для приготовления бесцветных растворов КОН, н|1 желтеющих и не темнеющих при употреблении и хране£ нии, рекомендован следующий прием. Около 5 мл бу*
тилата алюминия прибавляют при перемешивании к 1 л этилового спирта при температуре около 20 °С. Этой смеси дают стоять несколько недель, но не меньше месяца, после чего спирт осторожно сливают (лучше всего с применением сифона для декантации) и добавляют к нему требуемое количество КОН. Бутилат алюминия вызывает выпадение в осадок всех примесей, от которых зависит пожелтение или даже потемнение спиртовых растворов щелочей.
Для получения раствора NaOH можно пользоваться также амальгамой натрия. Для ее приготовления отвешивают 2,5 г металлического натрия и 100 г ртути. Ртуть наливают в пробирку, последнюю помещают в стакан, поставленный в фарфоровую чашку. Предварительно заготавливают несколько стеклянных палочек с оттянутым концом (длина палочек 35—40 см). На палочку надевают кусок асбеста так, чтобы при опускании палочки пробирка закрывалась асбестом. При помощи этой палочки вынимают из керосина кусочек металлического натрия величиной с горошину, быстро вытирают его фильтровальной бумагой и вносят в ртуть. Следует учитывать, что при этом возможна легкая вспышка. Постепенно вносят в ртуть весь металлический натрий. Получаемая амальгама (раствор металла в ртути) должна быть жидкой, но она может постепенно затвердеть. Жидкую амальгаму выливают в сосуд с водой, предварительно освобожденной от двуокиси углерода. Сосуд следует снабдить отводной трубкой с клапаном Бунзена. Если амальгама затвердеет, пробирку нужно разбить и кусочки амальгмы поместить в воду, не содержащую двуокиси углерода. Через два дня раствор едкого натра сливают со ртути и устанавливают его нормальность, как описано выше.
О приготовлении растворов, титр которых устанавливают по определяемому веществу, см. выше.
Для приготовления точных растворов щелочей используют также ионообменный способ. Аниониты могут быть применены для очистки растворов едкого натра и едкого кали от карбонатов и для приготовления точных растворов едкого натра и едкого кали, исходя из точных навесок хлористого натрия или хлористого калия.
Если нужно отделить только карбонаты и не загрязнять раствор ионами хлора, первые порции раствора, прошедшего через колонку в Cl-форме, отбрасывают до
тех пор, пока хлорид-ион не перестанет обнаруживаться в пробе раствора.
Насыщенный карбонат-ионами анионит можно сно- | ва перевести в Cl-форму обычным приемом, т. е. пропуская ■ через колонку с соляной кислотой, затем колонку хорошо промывают водой.
Для получения точного раствора едкого натра или | едкого кали рассчитанную навеску хлористого натрия или хлористого калия, отвешенную на аналитических весах, растворяют в дистиллированной или деминерализованной воде и полученный раствор пропускают через хроматографическую колонку (стр. 597), наполненную анионитом в ОН-форме. Из колонки будет вытекать раствор щелочи рассчитанной концентрации.
Точные растворы NaOH или КОН лучше всего сохранять в полиэтиленовой посуде, на которую щелочи не действуют, или в стеклянной посуде парафинированной внутри.
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной» и азотной кислотами. Эти кислоты имеются в продаже ву виде концентрированных растворов, процентное содер-ч жание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают техни-л ческие и чистые. Технические кислоты содержат примеси,! а потому при аналитических работах не употребляются.!
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу.1 Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11% хлористого водо-| рода.
Разбавление кислоты проводят по расчету, описанному выше (см. стр. 381).
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3.
По справочнику узнаем, что 5%-ный раствор имеет плотность» 1,024 г/см3; следовательно, 1 л ее будет весить 1,024-1000= 1024 г. В этом количестве должно содержаться чистого хлористого водородаЯ
100 — 5 1024-5
или х — 1ПП = 51,2 г
1024 — х 10°
Кислота с плотностью 1,19 г/см5 содержит 37,23% НС1 (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
100 — 37.23 100-51,2
х —51,2 *~ 37,23 -137,5 г
137 5 или - 1 jo = 115,5 мл кислоты с плотностью 1,19 г/см3. Отмерив
116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислоту к воде, а не наоборот. При разбавлении происходит сильное ра* зогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота порала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SOs. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением S03, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и S03 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавливания (см. стр. 388) при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в
случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твер-'} дые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-1 либо посторонним. При необходимости твердые органики ческие кислоты очищают перекристаллизацией (см. гл. 15
«Кристаллизаци я»).
Точные растворы. Точные растворы кислот готовят-так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точноД по расчету, разбавить. Для точных растворов берут тольв ко химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.^
Пример. Нужно приготовить 0,1 н. раствор H2S04. Это значит, что в 1 л раствора должно содержаться:
49,039
—j-jj— е» 4,9039 г серной кислоты
Кислота с плотностью 1,84 г/сма содержит 95,6% H2S04 и для приготовления 1 л 0,1 н. раствора нужно взять следующее коли* чество (х) ее (в г):
100 — 65,6 100-4,9039
*~=------ ос~ё----- = 5,1296 г
х — 4,9039 95.6
| .2,79 мл |
| 1,84 |
Соответствующий объем кислоты составит: 5,1296
Отмерив из бюретки* точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи и устанавли4 вают нормальность полученного раствора. Если раствор получите» более концентрированным, к нему добавляют из бюретки рассчи* тайное количество воды. Например, при титровании установлено! что 1 мл 0,1 н. раствора H2S04 содержит не 0,0049 г H2S04, a 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
1000 — 4,9 1000-5,1
у — ----- r-fi---- = Ю41 мл
х —5,1 4-9
Расчет показывает, что этот объем равен 1041 мл и в раствож нужно добавить 1041—1000 = 41 мл воды. Следует еще учесть т!
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном.
лоличество раствора, которое взято для титрования. Пусть взято
20 20 мл. что составляет ttjqq" = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41—(41-0,02) = = 41 — 0,8 = 40,2 мл.
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения.
Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку (см. стр. 597), наполненную катеонитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество НС1.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах. В пробку сосуда обязательно нужно вставлять хлор кальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2C03. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCOs, высушенным в эксикаторе над СаС13.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу и стандартных растворов кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Фиксаналы
Для быстрого приготовления точных растворов различных вещесгв (кислот, щелочей и солей) удобно применять фиксаналы. Это — заранее приготовленные
н запаянные в стеклянных ампулах точно отвешенные количества реактива, необходимые для приготовления 1 л 0,1 н. или 0,01 н. раствора.
|
Фиксаналы продаются в коробках, содержащих 10 ампул. На каждой ампуле имеется надпись, указывающая, какое вещество или раствор находится в ампуле, и количество вещества (0,1 или 0,01 г-экв).
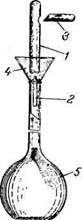
| Рис. 351. Прибор для приготовления растворов из фиксанала: / — ампула; 2 — боек; 3 — остроконечная палочка для пробивания ампулы сбоку; 4 — воронка, 5— мерная колба. |
Для приготовления точного раствора вначале теплой водой смывают надпись на ампуле и хорошо обтирают ее. В мерную колбу емкостью 1 л вставляют специальную воронку с вложенным в нее стеклянным бойком (обычно прилагается к каждой коробке фиксанала), острый конец которого должен быть обращен вверх (рис. 351). Если специальной воронки нет, можно пользоваться обычной химической воронкой, вставив в нее стеклянный боек. Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать так, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не изменяя положения ампулы, ее тщательно промывают дистиллированной водой из промы-валки. Для промывки рекомендуется употребить не менее чем шестикратное (по емкости ампулы) количество воды.
Промыв ампулу, ее удаляют, а раствор доливают дистиллированной водой до метки, закрывают колбу пробкой и встряхивают. Кроме жидких фиксаналов, имеются и сухие. При приготовлении из них растворов ампулу вскрывают так же, как описано выше. Нужно лишь заботиться о том, чтобы воронка была совершенно сухая. Когда ампула будет разбита, все содержимое ее осторожным встряхиванием высыпают в колбу, ампулу промывают дистиллированной водой.
В СССР выпускаются фиксаналы: H2S04; HC1; NaOH; КОН; Na2COs; NaHCCy, NaCl; KC1; Na2C204; HsC204;
КаСг«07; К2Сг04; Na2S203; KMn04; AgNG3; NH4SCN; KSCN; K2C204; NaSCN; (NH4)2C2Cv, l2; NaaB4Cy, BaCl2. Фиксаналы рекомендуется применять во всех случаях, когда требуется быстро приготовить точный раствор; они особенно удобны в мало оборудованных лабораториях, ь полевых условиях и пр. Щелочные фиксаналы пригодны только в течение определенного срока. Очень старые (2— 3-летней давности) щелочные фиксаналы могут оказаться уже неточными в результате загрязнения продуктами выщелачивания стекла. Остальные препараты, в особенности сухие, могут храниться неопределенно долгий срок.
Некоторые замечания о титровании и точных растворах
Установка титра — одна из ответственнейших опера ций лабораторной техники. От правильности приготовления титрованного раствора зависит и результат анализа. Не нужно забывать, что, например, на заводе на основе данных анализа осуществляется контроль за течением технологического процесса и неправильный анализ может повести к тем или иным осложнениям. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции.
Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. Титрованные растворы, на которые действует свет (растворы AgN03 и др.), следует хранить в желтых бутылях или в таких, которые бы защищали раствор от действия света.
4. При приготовлении растворов марганцевокислого калия титр их следует устанавливать не ранее чем через 3—4 дня после приготовления. То же относится ко всем другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
|
5,. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлор-кальциевая трубка с натронной известью или аскаритом). 6. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
7. При титровании кислых или щелочных растворов полезно применять так называемый раствор-свидетель.
Во время титрования колбу
нужно держать левой рукой, а
правой рукой управлять краном
бюретки, давая стекать жидкости
равномерно. При титровании
Рис. 352. Положение рук очень большое значение имеет
при титровании. скорость его. Поэтому при по-
вторном титровании одного и того же раствора нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Положение рук при титровании показано на рис. 352.
Для перемешивания титруемого раствора очень удобно применять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темноокрашенных жидкостей (см. стр. 409).
При аналитических работах большое внимание нужно уделять расчетам. Они не будут казаться трудными, если с самого начала работы усвоить понятия, которые лежат в основе всех расчетов, т. е. понятия о титре, нормальности и грамм-эквиваленте и о связи между ними.
Например, если взята какая-нибудь навеска нужного вещества, то титр Т приготовленного раствора будет равен навеске а, деленной на объем (V) раствора:
а а
Т=-р- или, если V =1000 мл, Т — |f)on
т. е. а= Т-1000 г.
Нормальность можно вычислить, если известна навеска а и грамм-эквивалент Е растворяемого вещества (т. е.
дг = JL если объем равен 100J мл). Е Если же раствор готовят в другом объеме, меньшем или большем, чем 1000 мл, навеску рассчитывают на 1 л, и тогда формула для вычисления нормальности примет
вид:
а-1000
Эта формула позволяет рассчитывать нормальность раствора из взятой навески независимо от его объема.
Между титром, грамм-эквивалентом и нормальностью существует простая зависимость:
N-EN-M
Т~Т0б0~ или 1 ^ЮООп
Т-1000 Т-1000 п
N — ------- g----- или Л' =-------- д}-----
Иногда при расчетах пользуются „поправкой на нормальность или коэффициентом нормальности К- Эта поправка является отношением титра практического Т к титру теоретическому (Т0):
К ="= "г-
Эта поправка показывает, какому количеству миллилитров точно нормального раствора соответствует 1 мл данного раствора. При умножении результатов титрования (мл) на эту поправку полученный объем приводят к определенной концентрации, например 0,1 н. раствору.
Однако целесообразность пользования поправкой на нормальность очень сомнительна, так как все расчеты можно с успехом делать и без этой поправки, только усложняющей расчет.
При работе с нормальными растворами задача всегда сводится вначале к определению нормальности неизвестного раствора, а затем к определению количества неизвестного вещества, содержащегося в растворе. Таким образом, основной расчетно-аналитической формулой при всех объемных определениях будет
W1-V1 = W2V2 (1)
26-117
| 26* |
т. е. произведение нормальности известного раствора на объем известного раствора при достижении конца реакции всегда равно произведению нормальности неизвестного раствора на объем последнего. Это произведение показывает число эквивалентов прореагировавших веществ. Отсюда можно определить нормальность неизвестного раствора N2, которая будет равна
«.-■^»
У2
Когда величина N2 известна, применяют общую формулу для определения нормальности по навеске (а):
а- 1000
W.-TT (3)
Поскольку задачей аналитика является определение величины а, из этой формулы находят:
NfV-E
а= 1000 (4)
Или, подставив значение N2 из формулы (2), получим:
NVVVV-E а - V2- 1000
где N± — нормальность известного раствора;
Vx — объем известного раствора, пошедшего на титрование; V2 — объем определяемого раствора; V — объем пробы неизвестного раствора; Е — грамм-эквивалент искомого вещества. Приведенные формулы позволяют проводить все расчеты без поправок на нормальность, так как принимается, j что она может быть выражена любым целым или дробным, числом. Главное во всяком расчете найти количество* эквивалентов, при умножении которых на величину грамм-1 эквивалента всегда получится количество искомого вещества.
Пример. Пусть была взята навеска 0,5000 г руды, содержащей^ железо. После ее растворения и разбавления полученного раствора! до 100 мл в мерной колбе для титрования методом перманганатоЯ метрии каждый раз берут по 10 мл анализируемого раствора, jj
Раствор КМп04 — 0,0495 н. На титрование пошло: 11,2; 11,1; 11,0; 11,1 мл раствора КМп04. Берем среднее 11,1 мл.
Нормальность раствора 11,1-0,0495= Ю-N2, 'откуда
11,1-0,0495
*»=—го—
Количество Fe в 100 мл раствора (грамм-эквивалент Fe в данном случае равен 55,85):
Nt-V-E 11,1-0,0495-100-55,85
а" 1000 * 10-1000 г
Чтобы выразить' содержание железа в руде в процентах, правую часть равенства умножают на 100 и делят на взятую навеску руды, т. е.
II,1-0,0495-100-55,85-100
а =----------- 10-1000-0,5000--------- = 60'68% Fe






