Цель работы: определение изменение энтропии при известных изменениях температуры и удельной теплоты плавления.
Необходимые приборы и пренадлежности: тигель с оловом; электроплитка, термопара, сосуд с водой, милливольтметр, секундомер.
Теоретическое введение
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. Термодинамическая система может находиться в различных состояниях, характеризуемыми температурой, объемом, давлением и т.д. Состояние термодинамической системы будет равновесным, если все
параметры состояния имеют определенные значения, не изменяющиеся с течением времени (при постоянных внешних условиях). Состояние системы называется неравновесным, если параметры характеризующие это состояние меняются. Переход системы из одного состояния в другой называется термодинамическим процессом.
Обратимым называется такой процесс, в конце которого
система возвращается к состоянию, в котором она была в начале процесса так, что в окружающей ее среде не остается никаких изменений. Другими словами, обратимый процесс- это такой процесс, который протекает чрезвычайно медленно, и система возвращается в первоначальное состояние пройдя те равновесные состояния в которых она находилась раньше, только в обратном порядке. Процесс, который не удовлетворяет вышеуказанному условию, называется необратимым процессом. Реальные процессы необратимы.
Примером обратимого процесса могло бы служить колебание маятника, если бы оно происходило без трения. В течении одного перехода колебания маятник возратился бы в начальное положение, причем ни в окружающей среде, ни в системе (маятнике) не осталось бы следов от происшедших за этот период изменений. Однако трение неустранимо. Поэтому часть механической энергии системы всегда переходит в теплоту и безвозвратно рассеивается в окружающей среде. Следовательно, механические процессы необратимы.
Вообще, в природе нет обратимых процессов. Наглядным примером необратимости реальных процессов являются процессы теплообмена и расширения газа в пустоту.
Теплота самопроизвольно переходит от горячего тела к холодному, но обратный самопроизвольный процесс не имеет места, так гласит второе начало термодинамики. Газ самопроизвольно расширяется в пустоту, но обратный процесс- самопроизвольное сжатие не имеет места.
Итак, в реальных условиях обратимые процессы неосуществимы. Однако, на практике можно с известным приближением некоторые процессы считать обратимыми. Обычно медленно (в идеальном случае очень медленно) протекающий процесс является обратимым.
Отношение теплоты, полученной системой к абсолютной температуре, при которой поисходила эта передача, называется приведенной теплотой 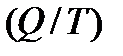 . В обратимых круговых процессах сумма приведенных теплот равна нулю:
. В обратимых круговых процессах сумма приведенных теплот равна нулю:
 (1)
(1)
А в пределе для любого обратимого процесса
 (2)
(2)
Подинтегральное выражение  представляет собой полный дифференциал некоторой функции
представляет собой полный дифференциал некоторой функции  , которая зависит только от состояния системы и не зависит от пути, каким система пришла в это состояние. Таким образом:
, которая зависит только от состояния системы и не зависит от пути, каким система пришла в это состояние. Таким образом:
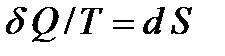 (3)
(3)
Согласно выражению (3), энтропия – это приведенная величина, характеризующая состояние системы, дифференциал которой равен отношению бесконечного малого количества теплоты, сообщенного системе в элементарном обратимом процессе, к температуре последней.
Функция  была введена Клаузиусом и названа им энтропией, в системе СИ измеряется в Дж/К. Наряду с энергией энтропия является важной характеристикой состояния системы. Каждому состоянию системы соответствует одно определенное значение энтропии. Поэтому энтропия является однозначной функцией состояния. Если посредством обратимого процесса система переходит из состояния 1 в состояние 2, то происходящее при этом изменение энтропии системы определяется путем интегрирования равенства (3)
была введена Клаузиусом и названа им энтропией, в системе СИ измеряется в Дж/К. Наряду с энергией энтропия является важной характеристикой состояния системы. Каждому состоянию системы соответствует одно определенное значение энтропии. Поэтому энтропия является однозначной функцией состояния. Если посредством обратимого процесса система переходит из состояния 1 в состояние 2, то происходящее при этом изменение энтропии системы определяется путем интегрирования равенства (3)

 (4)
(4)
Из формулы (2) следует, что для обратимых процессов изменение энтропии
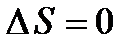 (5)
(5)
В термодинамике доказывается, что энтропия системы совершающей необратимый процесс возрастает
 (6)
(6)
Расчеты показывают, что при повышение температуры энтропия системы возрастает. Поскольку теплоте присуще наиболее беспорядочный характер движения материи (хаотическое движение молекул), то можно указать возрастанию энтропии соответствует увеличению беспорядка (хаоса) в состоянии системы. В этом смысле физический смысл энтропии можно определить как меру беспорядка
(хаоса) состояния системы.
Соотношение (5) и (6) можно определить в виде неравенства Клаузиуса
 (7)
(7)
т.е. энтропия изолированной системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Все реальные процессы являются необратимыми. Поэтому можно утверждать, что все процессы в изолированной системе ведут к увеличению ее энтропии (принцип возрастания энтропии).
Вместе с тем неравенство Клаузиуса указывает направление протекания реальных процессов: возможны лишь такие процессы, которые ведут к увеличению энтропии изолированной системы (второе начало термодинамики).






