Изотерма адсорбции Гиббса (2.30) показывает, что величина Г моно-
тонно возрастает с увеличением концентрации ПАВ в растворе. Это означает
постепенное уплотнение адсорбционного слоя, сближение адсорбированных
молекул. Этот процесс должен в конечном итоге привести к полному покры-
тию поверхности адсорбированными молекулами - н а с ы щ е н и ю ад-
сорбционного слоя, которому будет отвечать некоторое предельно большое
значение величины адсорбции Г∞. Представления о строении адсорбционных
слоев ПАВ получили теоретическое обоснование и экспериментальное под-
тверждение в работах Ленгмюра.
2.4.6. Теория мономолекулярной адсорбции Ленгмюра. Уравнение ад-
сорбции Ленгмюра было впервые получено на основе молекулярно-
кинетического подхода к описанию явления адсорбции газа (пара) на твердой
поверхности. При таком подходе адсорбция рассматривается как закрепление
молекул адсорбата на поверхности адсорбента под действием поверхностных
сил – нескомпенсированных на поверхности раздела фаз сил межмолекуляр-
ного взаимодействия. При разработке теории Ленгмюр исходил из следую-
щих предпосылок. 1) Адсорбционные силы имеют физическую природу, ад-
сорбция обратима и характеризуется установлением адсорбционного равно-
весия, имеющего динамический характер. Условие равновесия - равенство
скоростей прямого и обратного процессов – адсорбции и десорбции. 2) По-
верхность адсорбента энергетически неоднородна. Молекулы адсорбата за-
крепляются на а к т и в н ы х участках поверхности, каковыми являются пи-
ки, выступы, ребра трещин и т.д., где силы молекулярного взаимодействия
наименее скомпенсированы. Такие участки имеются на любой самой гладкой
поверхности. На рис. 2 схематически представлено различие между ак-
тивным (1) и неактивным (2) участками поверхности – скомпенсированная
часть молекулярно-силового поля заштрихована. (В случае адсорбции ПАВ
на границе раздела раствора с воздухом (или второй жидкой фазой) адсорби-
рующая поверхность однородна, молекулы ПАВ могут адсорбироваться на
любых свободных от ПАВ участках поверхности раствора). 3) Принимается
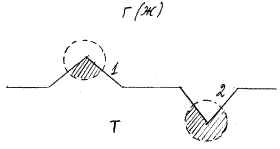 Рис.2. Энергетическая неоднородность по-
Рис.2. Энергетическая неоднородность по-
Верхности твердого тела
допущение: при закреплении одной молекулы адсорбата на активном центре
его молекулярно-силовое поле полностью насыщается, так что он становится
недоступным для присоединения второй молекулы. Из этого вытекает и сле-
дующее допущение: адсорбционный слой состоит только из одного слоя мо-
лекул (является мономолекулярным). При этом удельная адсорбция достига-
ет предельного значения Г∞. Для монослоя доля поверхности θ, покрытая мо-
лекулами адсорбата, будет равна θ = Г/Г∞, а доля оставшейся «свободной»
поверхности 1- θ = 1 - Г/Г∞.
В рамках этой модели скорость адсорбции va определяется выражени-
ем:
va = kac (1 - Г/Г∞),
т.к. она должна быть пропорциональна молярной концентрации адсорбата с и
доле незанятой поверхности. Здесь ka – константа скорости адсорбции. Ско-
рость десорбции vd пропорциональна только доле поверхности θ, занятой ад-
сорбированными молекулами: vd = kd θ,
где kd – константа скорости десорбции. При установлении адсорбционно-
гравновесия va = vd или
kac (1 - Г/Г∞) = kd θ,
откуда следует уравнение изотермы мономолекулярной адсорбции Ленгмюра
(2.35)

где К = ka/ kd – константа адсорбционного равновесия. Эта константа харак-
теризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это
взаимодействие, тем больше константа К. В случае ПАВ константа К харак-
теризует работу адсорбции Wа.
Уравнение Ленгмюра хорошо описывает экспериментальные изотермы
мономолекулярной адсорбции. Типичный вид такой изотермы представлен
на рис. 3. Она имеет два линейных участка: 1 - в области разбавленных
растворов и 2 - при высоких концентрациях, когда адсорбция достигает пре-
дельного значения Г = Г∞ = const. Преобразуем уравнение Ленгмюра для
этих двух частных случаев.
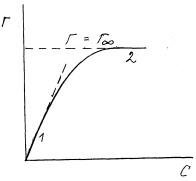 Рис.3. Типичный вид изотермы адсорбции Ленгмюра
Рис.3. Типичный вид изотермы адсорбции Ленгмюра
1) Пусть растворы разбавленные (с → 0). Тогда
Или


т.е. адсорбция линейно увеличивается с концентрацией, что соответствует
действию з а к о н а Г е н р и.
2) при больших концентрациях (с → ∞)

т.е. адсорбция достигает предельного постоянного значения.
Часто используют линейную форму уравнения Ленгмюра, с помощью
которого легко определить его константы Г∞ и К. Поделив величину с на ле-
вую и правую части уравнения Ленгмюра, получим:

т.е. уравнение прямой в координатах с/Г и с (рис. 2.18). Из уравнения
(2.37) и рис. 4 следует, что (1/Г∞) = tg α или Г∞ = ctg α. Константу ад-
станту адсорбции К легко рассчитать, учитывая, что отрезок, отсекаемый на
оси ординат, равен 1/(Г∞К).
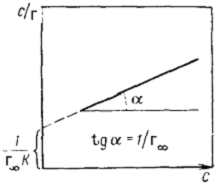 Рис. 4. Изотерма адсорбции в координа-
Рис. 4. Изотерма адсорбции в координа-




