Процесс биологического окисления представляет систему окислительно-восстановительных реакций, роль которых состоит в обеспечении организма энергией и метаболитами, получаемыми за счет восстановленных органических соединений. Посредством реакций биологического окисления разрушаются также вредные продукты обмена веществ и проникшие в организм чужеродные соединения. Различные органические соединения, поступающие в организм, обладают определенным уровнем потенциальной энергии («свободной энергией»). Основными экзогенными источниками энергии в организме являются углеводы, жиры, белки. Используя тот или иной субстрат, организм обеспечивает себя энергией в форме АТФ или фосфатсодержащих соединений.
13.1. Ферменты, катализирующие
окислительно-восстановительные реакции
Ферменты, катализирующие окислительно-восстановительные реакции, называют оксидоредуктазами. Их разделяют на 5 групп.
1. Оксидазы. Они катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород (рис. 42).

Рис. 42. Окисление метаболита, катализируемое оксидазой
Оксидазы содержат медь, продуктом реакции является вода. Широко распространена в растительных животных тканях цитохромоксидаза (цитохром а3). Она служит конечным компонентом цепи дыхательных переносчиков, локализованных в митохондриях, и катализирует реакцию, в результате которой электроны, высвобождающиеся из молекул субстрата при их окислении дегидрогеназами, переносятся на кислород.
Фенолаза катализирует превращение монофенола в о- фенол; уриказа, катализирует окисление мочевой кислоты в аллантоин; моноаминоксидаза окисляет адреналин и тиамин в митохондриях.
2. Аэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата; в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие как метиленовый синий (рис. 44).

Рис. 44. Окисление метаболита, катализируемое аэробной дегидрогеназой
Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода. Аэробные дегидрогеназы содержат в качестве простетической группы флавинмононкулеотид (ФМН) или флавнадениндинуклеотид (FФАД). (ФМН) и (ФАД) образуются в организме из рибофлавина (витамин В2). Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют флавопротеинами.
К ферментам группы аэробных дегидрогеназ относятся также дегидрогеназа (ФМН-содержащий фермент) L-аминокислот, катализирующая окислительное дезаминирование природных L-аминокислот. Широко распространена ксантиндегидрогеназа (ксантиноксидаза), она обнаружена в молоке, тонком кишечнике, почках и печени. Ксантиндегидрогеназа содержит молибден; играет важную роль в превращении пуриновых оснований в мочевую кислоту как главный конечный азотофиксирующий продукт метаболизма пуринов, а также катаболизма белков и аминокислот.
Альдегиддегидрогеназа – FAD-содержащий фермент, находящийся в печени млекопитающих. Это – металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты.
Глюкозооксидаза – FAD-специфичный фермент, получаемый из грибов; используется при определении глюкозы.
3. Анаэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода (рис. 45).

Рис. 45. Окисление метаболита, катализируемое анаэробной дегидрогеназой
Эти ферменты выполняют две главные функции:
а) Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции. Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же фермент или переносчик водорода.
б) Функцию компонентов дыхательной цепи, обеспечивающих транспорт электоронов от субстрата на кислород (рис.46).
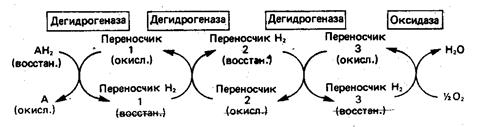
Рис. 46. Окисление метаболита анаэробными дегидрогеназами
и на завершающей стадии – истинной оксидазой дыхательной цепи
Среди анаэробных дегидрогеназ различают дегидрогеназы, зависимые от никотинамидных коферментов, рибофлавиновые дегидрогеназы, цитохромы. NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма – гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-зависимые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности, во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути.
Большинство раибофлавин-зависимых аэробных дегидрогеназ либо участвуют в транспорте электронов по дыхательной цепи, либо поставляют электроны для этой цепи. NADН-дегидрогеназа – компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например, сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь.
Цитохромы служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5), в растительных клетках, бактериях и дрожжах.
4. Гидроксипероксидазы – ферменты, использующие в качестве субстрата перекись водорода или органические перекиси. К этой категории относятся два типа ферментов: пероксидазы, находящиеся в составе молока, в растениях, лейкоцитах, тромбоцитах, эритроцитах и т.д., и каталаза, функционирующая в тканях животных и растений.
5. Оксигеназы – катализирующие прямое введение кислорода в молекулу субстрата. Оксигеназы не относятся к ферментам, катализирующим реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов. Ферменты этой группы делятся на две подгруппы:
а) Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
А + О2 ® АО2
Примером служат железосерные ферменты гомогентизатдиоксигеназа и 3-гидроксиантранилат-диоксигеназа, а также гемсодержащие ферменты, в частности L-триптофандиоксигеназа (триптофанпирролаза).
б) Монооксигеназы (оксидаза со смешанной функцией, гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для этой цели необходим дополнительный донор электронов (косубстрат):
А – Н + О2 + ZН2 ® А – ОН + Н2О + Z






