В состав белоксинтезирующей системы входят следующие компоненты:
1) рибосомные субъединицы 30S и 50S, образующие у прокариот рибосому 70S, или субъединицы 40S и 60S, образующие у эукариот рибосому 80S;
2) мРНК;
3) полный комплект аминоацил-тРНК, для образования которых необходимы аминокислоты, аминоацил-тРНК-синтетазы, тРНК и АТР;
4) инициаторная аа-тРНК. У прокариот – формилметионил-тРНК, у эукариот – метеонил-тРНК;
5) белковые факторы инициации трансляции. У прокариот – IF-1, IF-2, IF-3, у эукариот 9 факторов: еIF-1, еIF-2, eIF-3, eIF-4A, eIF-4B, eIF-4C, eIF-4D, eIF-5, eIF-6. Для инициации трансляции у эукариот абсолютно необходимы еIF-2, eIF-3 и eIF-5, остальные факторы усиливают функции этих трех;
6) белковые факторы элонгации: у прокариот – EF-Tu, EF-Ts, EF-G (Tu, Ts, G), у эукариот – EF-1 (аналог Tu), EF-2 (аналог EF-G);
7) белковые факторы терминации (или освобождения): у прокариот – RF-1 (R1), RF-2 (R2), RF-3 (S), у эукариот – еRF (для проявления активности ему необходим GTP);
8) некоторые другие факторы, еще недостаточно хорошо изученные (факторы диссоциации, ассоциации, высвобождения и др. белки);
9) GTP;
10) неорганические катионы Mg2+ или Са2+ и одновалентные (К+ или NH4+) в определенной концентрации.
В ходе синтеза белка информация, закодированная в мРНК, «читается» в направлении от 5ʹ- к 3ʹ-концу, обеспечивая синтез полипептида от N- к С-концу. У прокариот мРНК полицистронна, синтез белка на данной матрице начинается еще до того, как заканчивается процесс транскрипции (транскрипция и трансляция в прокариотических клетках сопряжены в пространстве и во времени). В отличие от прокариот, у эукариот мРНК моноцистронны и каждая мРНК кодирует строение только одной полипептидной цепи. В клетках эукариот синтез белка и транскриция разобщены. Транскрипция осуществляется в ядре клетки, трансляция ‒ в цитоплазме, куда из ядра поступают «зрелые», функционально активные молекулы мРНК.
Инициация трансляции
Рибосома должна узнать первый триплет кодирующей последовательности и там начать трансляцию. Необходима абсолютно точная инициация, поскольку правильность трансляции мРНК рибосомой зависит от правильной рамки считывания. Если произойдет сдвиг рамки считывания, аминокислотная последовательность полипептида, синтезированного в этом случае, окажется ошибочной, а образовавшийся продукт будет не способен выполнять функции белка, закодированного в данном гене.
В прокариотических клетках инициация трансляции является внутренней. Это означает, что рибосомная 30S-частица присоединяется к участку мРНК, содержащему инициирующий кодон AUG. Не имеет значения, на каком расстоянии от 5ʹ-конца мРНК кодон находится. Для прокариот этот способ инициации трансляции является оптимальным, поскольку он обеспечивает инициацию трансляции сразу нескольких цистронов внутри полицистронных мРНК.
В расположении 30S-субчастицы на мРНК важную роль играет последовательность Шайна-Дальгарно (рис.31.1), являющаяся элементом 5ʹ-нетранслируемой области прокариотической мРНК. Инициаторной аминоацил-тРНК у прокариот является fMet-тРНКfMet, взаимодействующая антикодоном UAC с колоном AUG на мРНК по принципу комплементарности.

Рис. 31.1. Присоединение 30S-частицы и fMet-тРНКfMet к МРНК у прокариот
У эукариот инициация трансляции называется терминальной инициацией. В этом случае 40S-частица сначала присоединяется к 5ʹ-концу мРНК, затем движется по мРНК до тех пор, пока не встретит инициирующий кодон. Этот процесс называют сканированием мРНК; он требует затраты энергии и является АТР-зависимым. В АТР-зависимом расплетании вторичной структуры мРНК и сканировании ее первичной структуры участвует специальный эукариотический фактор инициации eIF4, обладающий АТР-азной и хеликазной активностью. Когда рибосомная частица 40S встречается с инициирующим кодоном, антикодон инициаторной Met-тРНКMet взаимодействует с ним и сканирование прекращается (рибосомная частица нашла начало кодирующей последовательности мРНК).
Старт-кодоном в мРНК эукариот также является кодон AUG, но данный триплет может находиться в любой части мРНК, т.к. кодирует аминокислоту – метионин. В связи с этим существуют две различные тРНК, специфичные для метионина. Обе обладают одним и тем же кодоном, но одна используется только для инициации трансляции, а другая – только для включения метионина в процессе элонгации. Инициаторная тРНК имеет структурные особенности, которые распознаются инициаторным белком, или фактором инициации еIF-2, осуществляющим ее доставку к формирующемуся инициаторному комплексу. Мet-тРНК, участвующие в элонгации, опознаются другим цитоплазматическим фактором, который и доставляет ее к рибосоме. Этот фактор не связывается с инициаторной Met-тРНК.
В цитоплазме существует фонд свободных 30S- и 50S-субчастиц рибосомы. Белковый фактор IF-3 связывается с 30S-субчастицей и предупреждает реассоциацию рибосомных частиц при инициации трансляции. Этот фактор должен быть высвобожден до того, как 50S-субчастица сможет присоединиться.
Белковые факторы IF-1 и IF-2, связываясь с 30S-субчастицей, участвуют в процессе инициации и освобождаются в цитоплазму, чтобы функционировать вновь в новом акте инициации. Роль IF-1 точно неизвестна, а IF-2 необходим для связывания инициаторной fmet-тРНКfmet (рис.31.2).

Рис.31.2.Образование инициирующего 70S- комплекса у прокариот
Участки Р и А окончательно формируются только при присоединении 50S-субчастицы. Во время синтеза белка Р-сайт оккупируется молекулой тРНК, на которой находится растущая полипептидная цепь; А-сайт занят аминоацил-тРНК. Растущая полипептидная цепь проходит через туннель на большой субчастице (рис.31.3).

Рис.31.3. 70S- инициирующий комплекс у прокариот
Кроме А-сайта (акцепторного) и Р-сайта (донорного) в 70S-комплексе формируется Е-сайт, с которого уходит деацилированная (без аминокислоты) тРНК (рис. 31.4).

Рис. 31.4. Схема РНК-связывающих участков рибосомы: А ‒ аминоацил-тРНК-связывающий участок; Р ‒ пептидил-тРНК-связывающий участок, Е ‒ участок выхода тРНК (от англ. exit)
Элонгация трансляции
Выделяются следующие три стадии элонгации трансляции:
Стадия 1. Кодонспецифический выбор аа-тРНК. Требует обязательного участия белковых факторов Tu, Ts и GTP. Реакции протекают в следующей последовательности. Вначале в результате взаимодействия между белковым фактором EF-Tu и GTP образуется относительно нестабильный комплекс EF-Tu-GTP. Образованный комплекс неспецифически связывает одну молекулу любой аа-тРНК:
EF-Tu-GTP + аа-тРНК → аа-тРНК-EF-Tu-GTP
Далее происходит связывание аа-тРНК-EF-Tu-GTP на R-участке, которое происходит, вероятно, еще во время предыдущего рабочего цикла рибосомы. Комплекс аа-тРНК- EF-Tu-GTP некоторое время удерживается на участке предварительного узнавания (до переноса на А-сайт). Механизм этого переноса остается неизвестным.
70S-мРНК + аа-тРНК- EF-Tu-GTP → 70S-мРНК-аа-тРНК- EF-Tu-GTP
Следующий этап ‒ гидролиз GTP до GDP, который остается в комплексе с EF-Tu и Н3РО4. Они высвобождаются из рибосомы. В цитоплазме происходит при участии фактора EF-Ts возвращение EF-Tu-GDP в исходное состояние:
EF-Tu-GDP + EF-Ts + GTP → EF-Tu-GTP + EF-Ts + GDР
На рис. 31.5 приведен циклический процесс регенерации EF-Tu-GDP.

Рис.31.5. Регенерация EF-Tu-GDP в EF-Tu-GTP
Стадия 2. Транспептидация. Свободная NH2-группа аа-тРНК ориентируется рядом с этерифицированным карбоксилом пептидил-тРНК. Такое пространственное сближение субстратов пептидилтрансферазного центра (ПТЦ) является необходимым и достаточным условием образования между ними пептидной связи. Эта реакция катализируется самим ПТЦ. В процессе транспептидации пептидил, связанный через СОО-группу с тРНК в донорном центре, покидает свою тРНК (она становится деацилированной) за счет замыкания пептидной связи переносится на NH2-группу аминокислоты аа-тРНК.
В результате единичной транспептидации пептидил удлиняется на одни аминокислотный остаток. Необходимая для этогог энергия запасена в сложноэфирной связи пептидила (fmet) и концевого аденозина тРНК (рис.31.6).
Важным следствием транспептидации является резкое снижение прочности удержания измененных субстратов ПТЦ- деацилированную тРНК в донорном участке и пептидил-тРНК в акцепторном участке, что необходимо для прохождения следующей стадии цикла – транслокации.
Стадия 3. Транслокация. После замыкания петидной связи донорная тРНК, лишившаяся пептидила, занимает донорный участок, а пептидил оказывается связанным с акцепторной тРНК в А-участке. Такое состояние рибосомы и пептидил-тРНК называется претранслоцированным.
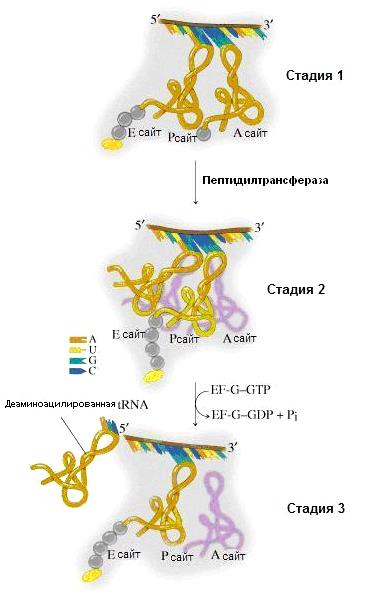
Рис.31.6. Элонгация трансляции у прокариот
Чтобы рибосома могла присоединить очередную аа-тРНК и образовать следующую пептидную сявзь, в ней должны произойти пространственные перемещения некоторых компонентов. Этот процесс получил название транслокации. Она включает следующие события:
1). Перемещение пептидил-тРНК с акцепторного на донорный участок – транслокация тРНК;
2). Вытеснение деацилированной тРНК из Р-участка;
3). Перемещение рибосомы вдоль мРНК в направлении 5′ → 3′ на один кодон и установка в акцепторном участке нового кодона – транслокация рибосомы или транслокация мРНК.
Во время транслокации очередная аа-тРНК, вероятно, перемещается из R-участка в А-участок (рис.31.6).
Транслокация в клетке происходит с участием белкового фактора EF-G связанного с GTP (транслоказа). Для удаления EF-G из рибосомы, которое происходит сразу после транслокации, необходим нидролиз GTP. Такое состояние рибосомы называется посттранслоцированным. Рибосома способна повторить весь цикл снова.
Таким образом, на этап элонгации затрачивается две молекулы GTP.
Терминация трансляции
Терминация трансляции – это процесс завершение синтеза п/п цепи и освобождение ее из связи с последней тРНК и рибосомой. Сигналом о завершении трансляции является один из трех бессмысленных кодонов: UAA, UAG, UGA. Помимо терминирующих кодонов в терминации трансляции участвуют три белковых фактора – RF-1, RF-2, RF-3.
Основные стадии терминации:
1). Узнавание терминирующего кодона.
Рибосома должна находиться в посттранслоцированном состоянии. ТТ начинается с того, что в А-сайт поступает один из терминирующих кодонов. Поскольку этим кодонам не соответствует какая-либо аа-тРНК, с этим участком связывается один из факторов терминации – RF-1 или RF-2. Эта реакция стимулируется фактором RF-3.
2). Гидролиз сложноэфирной связи между С-концом пептидила и ССА-концом донорной тРНК.
Эта реакция осуществляется ПТЦ рибосомы. Факторы терминации делают его способным переносить пептидил на Н2О, вследствие чего пептидил отделяется от рибосомы, но мРНК и деацилированная тРНК продолжают на ней удерживаться. На этом процесс терминации трансляции заканчивается, и все последующие стадии необходимы только для подготовки рибосомы к следующей трансляции.
3). Освобождение рибосомы из комплекса с мРНК и тРНК.
Фактор ERF, фактор элонгации EF-G и GTP. Механизм неизвестен.
4). Диссоциация рибосомы 70S
Эта стадия протекает с участием IF-3, который специфически взаимодействуя с 30S, способствует ее отделению от 50S.
Эффективность трансляции
Под эффективностью трансляции понимают скорость включения аминокислот в полипептидной цепи. В оптимальных условиях время, необходимое для синтеза п/п цепи, включающей 300-400 а.о., составляет у Е.соli 10-20 сек, 30-40 (15-20) а.о./сек. У эукариот за секунду включается в п/п цепь 10 а.о.
Следовательно, элонгация п/п цепи небольших размеров продолжается менее 10-30 секунд. Скорость синтеза белка в ретикулоцитах составляет около 1 триплета в секунду и около 7-10 триплетов в секунду у Е.соli.






