комплексов: NADH-дегидрогеназы, сукцинатдегидрогеназы, цитохромов вс1, цитохромоксидазы. Роль коэнзима Q и цитохрома с в интеграции комплексов. Коллекторная функцияNAD+ и коэнзима Q в дыхательной цепи. Коэффициент окислительного фосфорилирования Р/О, Р/2е
Основные переносчики электронов дыхательной цепи организованы в 4 комплекса. Пространственное расположение компонентов таково, что оно облегчает их функционирование и соответствует возрастанию окислительно-восстановительного потенциала. Во внутренней мембране митохондрий выделяют 4 ферментных комплекса: NADH-дегидрогеназа (комплекс I), сукцинатдегидрогеназа (комплекс II), цитохромы bс1 (комплекс III) и цитохромоксидаза (комплекс IV).
Три комплекса – I, III и IV – функционируют как зависящие от транспорта электронов протонные помпы, т.е. используя энергию электронов, эти комплексы обеспечивают перенос Н+ из матрикса в межмембранное пространство. В результате возникает протонный электрохимический потенциал. Комплекс II катализирует окисление сукцината убихиноном. При достижении определенного значения электрохимического потенциала происходит активация АТФ-синтазы (комплекс V), в ней открывается канал, через который протоны возвращаются из межмембранного пространства, а энергия ΔmН+ используется для синтеза АТР. Каждый из трех комплексов обеспечивает необходимый протонный градиент для активации АТФ-синтазы и синтеза 1 молекулы АТР.
Митохондриальная протон-транслоцирующая NADH-дегидрогеназа (первый пункт энергетического сопряжения) катализирует окисление NADH убихиноном. Реакция сопровождается трансмембранным переносом 4-х протонов при окислении одной молекулы NADH (2 электрона) и генерацией на сопрягающей мембране митохондрий разности электрохимических потенциалов. Комплекс I состоит из 46 субъединиц. В составе фермента обнаружено несколько редокс-компонентов, участвующих в передаче электронов с NADH на убихинон – FMN, несколько Fe-S-кластеров и прочно связанный убихинон (Рис.26.4).
На рис. 26.4. контуры поверхности белка приведены по данным реконструкции электронных микрофотографий фермента N.сrassa. Гидрофобный домен фермента погружен в липидный бислой. Расположение отдельных субъединиц в мембранной и периферической части фермента показано на основании результатов хроматографического разделения Комплекса I сердца быка на отдельные фрагменты.
Комплекс II (молекулярная масса 125 кДа) катализирует окисление сукцината убихиноном. Он состоит из 4 субъединиц: флавинопротеина, с молекулярной массой 70 кДа; железосерного белка, с молекулярной массой 30 кДа и двух гидрофобных заякоренных субъединиц по 7 и 17 кДа. Флавинопротеид содержит ковалентно связанный флавинмононуклеотид. Железосерные белки – это три различных железосерных кластера: [2Fe-2S] – центр S1; [3Fe-4S] – центр S2; [4Fe-4S] – центр S3. Две субъединицы являются цитохромом b и убихинон-связывающим белком.
Комплекс III имеет четыре редокс-центра: гемы bl и bh, связанные с цитохромом b; негемовый железосерный кластер FeSIII; включенный в соответствующий апопротеин; гем с, присоединенный к апопротеину цитохрома с1 (Рис.26.5). Наряду с переносчиками восстановительных эквивалентов в состав комплекса входит 8 полипептидов, лишенных простетических групп. Функционирует комплекс III по типу Q-цикла. Участвует в генерации протонного градиента, перенося 2 протона водорода из матрикса в межмембранное пространство.
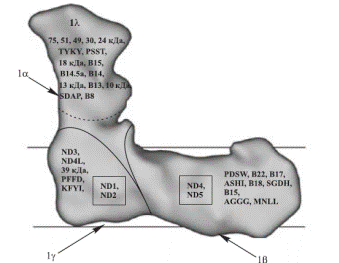
Рис.26.4. Схематическое изображение структуры комплекса I
Цитохромоксидаза (комплекс IV) катализирует окисление восстановленного цитохрома с молекулярным кислородом. Эта реакция сопряжена с генерацией ΔμН. Восстановитель цитохромоксидазы цитохром с представляет собой очень стабильный гемопротеин, состоящий из 104 аминокислот и гема с. Гем ковалентно связан с апобелком (через SH-группы Cys-14, Cys-17). Цитохромоксидаза содержит 4 редокс-центра: 2 гема а -типа (а и а3) и 2 атома меди (CuA и CuB). Цитохромоксидаза содержит 3 крупные субъединицы, кодируемых митохондриальной ДНК, и еще 9 мелких субъединиц, синтезируемых в цитоплазме. Цитохромоксидаза частично погружена в мембрану, а частично экспонирована в воду. Гемы ориентированы перпендикулярно плоскости мембраны.
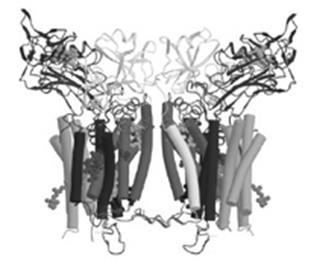
Рис.26.5. Комплекс III (bc1)
Электрон, отнятый от цитохрома с переносится непосредственно на Cuа. Двигаясь от поверхности в глубь мембраны, электрон переносится от Cuа к гему а и далее к комплексу гема а3 и Cub – последнему компоненту в дыхательной цепи, который восстанавливает О2.
Между комплексами электроны переносятся с помощью подвижных переносчиков: убихинона и цитохрома с. Двигаясь диффузно через липидный бислой мембраны, убихинон связывает комплексы I и III. Цитохром с выполняет аналогичную челночную функцию на участке между комплексами III и IV, диффундируя вдоль поверхности мембраны.
Функцию коллектора восстановительных эквивалентов в дыхательной цепи выполняют NAD+ и убихинон. Восстановительные эквиваленты могут поступать в дыхательную цепь на ее различных уровнях, в зависимости от редокс-потенциала окисляемого субстрата. Если он меньше, равен или немного больше -0,3 В (редокс-потенциал пары NADН/NAD+), в окислении такого субстрата участвует вся дыхательная цепь. Именно так окисляется большинство субстратов. Часто NAD+ служит непосредственным окислителем субстрата (ЦТК, окисление жирных кислот и т.д.). В редких случаях NADP, а не NAD служит окислителем субстрата. Образовавшийся NADPH может восстанавливать NAD+ в трансгидрогеназной реакции. Однако этого не происходит в энергезированной мембране, т.к. трансгидрогеназа служит потребителем ΔμН, действующим в направлении NADPH→NADP +. По этой причине NADPH обычно не подключается к дыхательной цепи, а используется в реакциях восстановительных биосинтезов.
Если редокс-потенциал субстрата значительно ниже, чем у NAD +, восстановительные эквиваленты переносятся на средний или конечный участок дыхательной цепи. Так окисляется один из субстратов цикла трикарбоновых кислот сукцинат (редокс-потенциал +0,03 В), а также ацил-СоА – субстрат первой оксидоредукции в системе β-окисления жирных кислот. Сукцинат и ацил-СоА-дегидрогеназы питают электронами дыхательную цепь на уровне комплекса bc1. В очень редких случаях редокс-потенциал окисляемого субстрата более положителен, чем у СоQ. Тогда восстановительные эквиваленты входят в цепь на уровне цитохрома с, так что только цитохромоксидазый ΔμН-генератор участвует в трансформации энергии. Пример – аскорбиновая кислота.
Мерой эффективности дыхания как поставщика энергии для синтеза АТР, предложенной в 1939 г. В.А. Белицером и Е.Т. Цыбаковой, может служить отношение количества синтезированного АТР или эстерифицированного фосфата к количеству потребляемого кислорода (АТР/O, P/O, Р/2е). Этот критерий, называемый коэффициентом фосфорилирования, отражает количество молей АТР, образованных при восстановлении 1 атома кислорода до Н2О дыхательной цепи (т.е. при прохождении 2 электронов по дыхательной цепи). Для митохондрий, окисляющих NAD-зависимые субстраты, сукцинат или аскорбат, экспериментально измеренные величины Р/O оказываются соответственно 3, 2, 1. Эти величины близки величинам, рассчитанным теоретически.
При участии АТР/АDP-транслоказы АТР транспортируется в цитоплазму в обмен на ADP. В цитоплазме АТР используется для совершения работы. При увеличении расхода АТР в клетке увеличивается поступление ADP в митохондрии. Повышение концентрации ADP (субстрата АТФ-синтазы) увеличивает скорость синтеза АТР. При этом увеличивается скорость дыхания. Таким образом, скорость синтеза АТР точно соответствует потребностям клетки в энергии. Ускорение окислительного фосфорилирования и дыхания при повышении концентрации ADP называется дыхательным контролем.
В реакциях дыхательной цепи часть энергии не превращается в энергию макроэргических связей АТР, а рассеивается в виде тепла. Тепло, освобождающееся в реакциях энергетического обмена, участвует в поддержке температуры тела у теплокровных животных. Некоторые липофильные вещества (жирные кислоты, динитрофенол и др.) могут переносить ионы водорода через внутреннюю мембрану митохондрий, минуя канал АТР-синтазы, убирая таким образом протонный градиент. Они разобщают процесс переноса электронов по дыхательной цепи и синтез АТР и поэтому называются разобщителями. При действии разобщающих факторов коэффициент Р/О снижается, часть энергии выделяется в виде тепла.






