И. В. ЦЕЛИНСКИЙ, С.Ф.МЕЛЬНИКОВА
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
ЭЛЕКТРОФИЛЬНОГО НИТРОВАНИЯ
Т е к с т л е к ц и й
Санкт-Петербург
УДК 547.546: 541.128
Целинский И.В., Теоретические основы электрофильного нитрования: Текст лекций / И.В Целинский, С.Ф. Мельникова.- СПб.: СПбГТИ (ТУ), 2011.- 113 с.
Излагаются механизмы процессов ароматического нитрования, ионно-молекулярное строение и активность нитрующих систем, влияние структурных эффектов и эффектов среды на кинетику и механизм нитрования.
Учебное пособие предназначено для студентов 3-5 курсов по специальности 240701-«Химическая технология органических соединений азота» в соответствии с ГОС-2, по специальности 240300- химическая технология энергонасыщенных материалов и изделий, специализация 240301-«Химическая технология органических соединений азота» в соответствии с ФГОС, бакалавров по направлению 240100-«Химическая технология», также для аспирантов по специальностям 05.17.07- «Химическая технология топлива и высокоэнергетических веществ» и 02.00.03-«Органическая химия» и соответствует программе дисциплины «Теоретические основы электрофильного нитрования».
Изучение данной дисциплины способствует освоению профессиональных компетенций: ПСК 1.1-1.4..
Рис.18, табл. 8, библиогр. 7 наим.
Рецензенты:
1. СПб Госуниверситет кино и телевидения, кафедра общей, органической и физической химии, д-р хим. наук, профессор Л.Л.Кузнецов
2. Б.М.Ласкин, д-р техн. наук, профессор, начальник научно-исследовательского комплекса «Экология и промышленная безопасность РНЦ «Прикладная химия»
Утверждено на заседании учебно-методической комиссии факультета тонкого органического и микробиологического синтеза СПбГТИ (ТУ)
Рекомендовано к изданию РИС’о СПбГТИ (ТУ)
Введение
Электрофильное нитрование в течение более чем 170 лет является главным методом получения ароматических моно- и полинитросоединений, нитратов спиртов и N-нитроаминов. Первая страница истории ароматических нитросоединений была открыта в 1834 г немецким химиком Митчерлихом, впервые получившим нитробензол нитрованием бензола азотной кислотой. Спустя 8 лет, в 1842 г, французский химик – органик Огюст Лоран получил пикриновую кислоту (от греческого «пикрос»-горький), или 2,4,6- тринитрофенол, который до 1884 г использовался как лимонно-желтый краситель для шелка и шерсти, а позже – как бризантное взрывчатое вещество (ВВ)*.
В течение 30-40-х годов XIX века химики различных стран Европы, исследуя взаимодействие органических веществ с азотной кислотой, открыли новые нитросоединения.
Так, в 1833 г французский химик Анри Браконно впервые синтезировал тринитрат целлюлозы (нитроцеллюлозу, пироксилин) и нитрокрахмал, т.е. нитраты многоатомных спиртов. В 1836 г О.Лоран получил нитронафталин и определил его строение. В 1846 г итальянский химик Асканьо Собреро нитрованием глицерина смесью серной и азотной кислот впервые синтезировал самое мощное в то время ВВ – нитроглицерин.
В том же году немецкий химик Кристиан Фридрих Шенбейн независимо от Браконно получил нитроцеллюлозу и изучил ее свойства. Другой известный немецкий химик Вильбранд в 1863 г впервые получил 2,4,6-тринитротолуол (ТНТ, тротил), который в течение более ста лет оставался основным штатным бризантным ВВ. ______________________________________________________________
*По другим данным (Е.Ю.Орлова, «Творцы и носители идеи взрыва», М.Изд. центр РХТУ им Д.И.Менделеева, 2003, с. 19) пикриновая кислота была впервые получена в 1800 г немецким химиком Гусманом. Имеются также данные, что пикриновая кислота была впервые выделена в 1771 г Вульфом из продуктов нитрования индиго.
Первый ароматический N-нитроамин - тетрил (N,2,4,6-тетранитро-N-метиланилин) был синтезирован немецким химиком Мертенсом в 1877 г.
Мощный толчок развитию исследований в области нитросоединений и их применению в народном хозяйстве дала открытая известным российским ученым Н.Н.Зининым в 1842 г реакция восстановления ароматических нитросоединений в амины.
До начала XX века основным потребителем нитросоединений было производство порохов и ВВ и в значительно меньшей мере - красителей, гербицидов, пластмасс, фармацевтических препаратов и полупродуктов органического синтеза.
Однако во второй половине прошлого века большая часть произведенных ароматических нитросоединений стала направляться на производство полимеров, главным образом полиуретанов, объем производства которых достиг 5 млн. т в год.
Основными исходными материалами для них являются нитробензол, 2,4- и 2,6-динитротолуолы, производство которых превышает 1 млн.т в год.
Важными каналами потребления ароматических нитросоединений остаются производства антиоксидантов для резин, лекарственных средств, пищевых красителей, отбеливателей, гербицидов и т.д.
Общие вопросы электрофильного нитрования
Электрофильное нитрование важно не только как основной метод получения нитросоединений, но также благодаря той роли, которое оно сыграло в развитии теоретической органической химии. Электрофильное замещение, наиболее полно исследованное на примере нитрования, составляет самую важную группу реакций ароматических соединений. Вряд ли найдется какой-либо другой класс реакций, который так детально, глубоко и всесторонне исследован как в отношении механизма, так и с точки зрения широкого применения в органическом синтезе. Именно в области электрофильного ароматического замещения впервые была поставлена проблема связи между структурой и реакционной способностью, которая является основным предметом изучения в физической органической химии.
Реакции нитрования можно подразделить на ионные, или гетеролитические, ион-радикальные и свободно-радикальные. Поскольку основные понятия и определения, касающиеся механизмов органических реакций, рассматриваются в курсе «Количественная теория органических реакций»*, здесь дается лишь краткое пояснение соответствующих терминов.
Итак, гетеролитические реакции включают либо разрыв ковалентной связи так, что оба электрона остаются у одного из продуктов, в результате чего возникают положительно и отрицательно заряженные ионы, либо образование ковалентной связи за счет пары электронов одного из реагентов и вакантной орбитали (т.н. «электронной дырки») другого.
 Реагент, несущий неподеленную пару электронов и/ или отрицательный заряд, называется нуклеофилом, а электронодефицитный реагент – электрофилом.
Реагент, несущий неподеленную пару электронов и/ или отрицательный заряд, называется нуклеофилом, а электронодефицитный реагент – электрофилом.
Электрофильные реагенты можно условно разделить на три группы – сильные, средней силы и слабые.
К сильным электрофилам относится ион нитрония, NO2+ (O=N+=O, изоэлектронный аналог диоксида углерода, O=C=O, кетена O=C=CH2 и аллена, CH2=C=CH2) – основной нитрующий агент в электрофильном ароматическом нитровании, ион гидросульфония, HSO3+ (протонированный серный ангидрид) – активный сульфирующий агент, комплексы галогенов (Cl2, Br2) с кислотами Льюиса (BF3, AlCl3, FeCl3, PF5, SbF5 и т.д.).
*) И.В.Целинский, С.Ф.Мельникова. Количественная теория органических реакций. Ч.I. Механизмы реакций органических соединений. Текст лекций. Санкт-Петербург. СПбГТИ (ТУ), 2010, 55 с.
К слабым электрофилам относятся катионы нитрозония, NO+ (N≡O+ - изоэлектронный аналог ¯C ≡O+) - основной нитрозирующий агент, катион диазония Ar-N  ≡N, диоксид углерода – один из самых слабых электрофилов.
≡N, диоксид углерода – один из самых слабых электрофилов.
Сильные электрофилы взаимодействуют с ароматическими соединениями, содержащими как электронодонорные, так и электроноакцепторные заместители (понятие о трех типах заместителей и их ориентирующем влиянии см. ниже, стр.23-24). Слабые электрофилы взаимодействуют только с производными бензола, содержащими сильные электронодонорные группы (OH, OR, NH2, NR2, -O- и др.).
Большинство реакций нитрования относятся к типу процессов электрофильного замещения, где один электрофил замещает другой в молекуле субстрата. Ион-радикальные и свободно-радикальные процессы играют значительно меньшую роль в реакциях нитрования и поэтому будут лишь кратко упомянуты в этом курсе.
Электрофильное ароматическое замещение, в частности нитрование, по механизму существенно отличается от замещения в алифатическом ряду, где возможны 2 типа процессов - SE2-синхронное бимолекулярное электрофильное замещение, т.е. одновременное образование ковалентной связи субстрата с электрофилом и разрыв связи с уходящей группой, либо SE1, при котором вначале разрывается связь субстрата с уходящей группой, а затем образовавшийся анион (например, карбанион) атакуется другим электрофилом.
Механизм SE2 реализуется, в частности, при нитровании алканов солями нитрония (работы Джорджа А. Ола) (схема 1.1):

Схема 1.1
Нитроний – ион в исходном состоянии имеет sp -гибридизованный атом азота (угол O-N-O равен 180оС). У него отсутствует вакантная р -орбиталь, способная разместить электроны σ -связи C-H или C-C. Поэтому в процессе активации происходит частичное изменение гибридизации азота от sp (линейная гибридизация) до sp2 (плоская тригональная гибридизация), что освобождает пустую р -орбиталь для образования в медленной стадии трехцентровой двухэлектронной связи.
Последующее быстрое отщепление протона или алкильного катиона приводит к продуктам замещения. Процессы электрофильного замещения имеют место также в ряду металлоорганических соединений, т.к. металлы (например, ртуть) склонны отщепляться в виде катионов (схема 1.2):
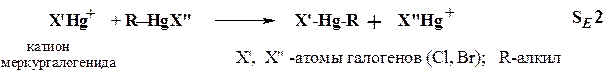
Схема 1.2
Если алкильная группа R дает нестабильный высокоосновный анион, реализуется синхронное SE2 -замещение. В случае образования стабильных карбанионов R¯(например, C2H5-OCO(C6H5)CH¯) имеет место S E 1-замещение (схема 1.3):

Схема 1.3
В ароматическом электрофильном замещении, в частности нитровании, обычно вначале к молекуле субстрата присоединяется электрофильный реагент E+ с образованием промежуточного аренониевого иона, или
σ-комплекса, от которого затем отщепляется протон или другая уходящая катионоидная группа (схема 1.4):

Схема 1.4
Такой механизм получил название SEAr, т.е. электрофильное ароматическое (или аренониевое) замещение. В этом случае 6π-электронная система бензола в σ-комплексе исчезает и заменяется на 4 π-электронную
систему аренониевого катиона (схема 1.5):

Схема 1.5
а на второй стадии ароматическая система восстанавливается.
Электронное строение ароматических соединений
 Первый ароматический углеводород – бензол был выделен Майклом Фарадеем в 1825 г из конденсата осветительного газа. В 1833 г Митчерлих впервые синтезировал чистый бензол и установил его брутто-формулу С6Н6. Термин «ароматический» возник потому, что многие производные бензола – спирты, альдегиды, простые и сложные эфиры, содержащие радикал фенил (С6Н5), были выделены из ладана, ароматических масел и бальзамов (затвердевшей смолы хвойных деревьев). Немецкий химик Кекуле предложил для бензола формулу гексагонального 1,3,5-циклогексатриена:
Первый ароматический углеводород – бензол был выделен Майклом Фарадеем в 1825 г из конденсата осветительного газа. В 1833 г Митчерлих впервые синтезировал чистый бензол и установил его брутто-формулу С6Н6. Термин «ароматический» возник потому, что многие производные бензола – спирты, альдегиды, простые и сложные эфиры, содержащие радикал фенил (С6Н5), были выделены из ладана, ароматических масел и бальзамов (затвердевшей смолы хвойных деревьев). Немецкий химик Кекуле предложил для бензола формулу гексагонального 1,3,5-циклогексатриена:
В этой формуле все атомы углерода и водорода эквивалентны.
Эта формула объясняет существование трех дизамещенных производных толуола орт о-(1,2-), мета- (1,3-) и пара- (1,4-) (схема 1.6):

Схема 1.6
Однако химические свойства бензола (трудность присоединения по кратным связям, окисления и т.д.) кардинально отличают его от гипотетического 1,3,5-циклогексатриена. Поэтому формула Кекуле, хотя и удобна для написания, не отражает истинную структуру бензола, в которой все связи С-С и С-Н одинаковы и отсутствует альтернирование (чередование) простых и двойных связей. Молекула бензола представляет собой плоский правильный шестиугольник с длиной связей С  С 1.397Å и валентными углами 1200С.
С 1.397Å и валентными углами 1200С.
Все атомы углерода находятся в плоском тригональном (sp2) состоянии гибридизации, где σ-связи С-С, формирующие каркас молекулы, образованы гибридными sp 2 орбиталями с аксиальным (осевым) перекрыванием  (рис.1).
(рис.1).

Рисунок 1. Остов молекулы бензола. Рисунок 2. Боковое перекрывание






