В металлах атомы можно рассматривать как положительные ионы, образующие кристаллическую решетку, состояние которой соответствует равновесию сил взаимодействия между ними и минимальному значению общей энергии всех частиц твердого тела. Внутри пространственной решетки происходит беспорядочное движение электронов, образующих как бы «электронный газ» и «цементирующих» катионную кристаллическую решетку.
Благодаря взаимодействиям многих частиц каждый из энергетических уровней отдельного атома металла в металлическом кристалле несколько размывается, он как бы расщепляется на несколько уровней, образующих зону с разрешенными значениями энергии электрона. Электроны внешней оболочки атомов заполняют энергетические уровни, составляющие валентную зону. Уровни с более низкими энергиями электрона входят в состав других зон, заполненных электронами. Эти зоны для рассмотрения интересующей нас проблемы прохождения электрического тока через металлы значения не имеют.
Высокий запас энергии электронов валентной зоны приводит к их большой подвижности. Под влиянием приложенной к металлу разности потенциалов электроны, обладающие энергией, которая превышает определенное значение, получают направленное движение. Эти электроны находятся в зоне проводимости и называются электронами проводимости. В металлах валентные зоны и зоны проводимости перекрывают друг друга, т. е. часть электронов валентной зоны находится одновременно в зоне проводимости, что приводит к высокой проводимости металлов.
В полупроводниках с электронной проводимостью дело обстоит иначе. В них электроны валентной зоны обладают низким запасом энергии, они заполняют почти все уровни этой зоны и не могут передвигаться под воздействием приложенного электрического поля. Только небольшая часть электронов валентной зоны благодаря флуктуации энергии находится в зоне проводимости и способна переносить электрический ток.
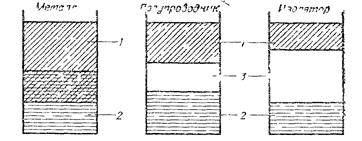
Рис. 2.6. Схема зон проводимости (1), валентных зон (2) и запрещенных зон (3) в металле, полупроводнике и изоляторе.
Чтобы электроны из валентной зоны перешли в зону проводимости, они должны получить определенное количество энергии, достаточное для преодоления запрещенной зоны. В изоляторах все электроны находятся в валентной зоне, а в зоне проводимости они отсутствуют. Это обусловлено тем, что ширина запрещенной зоны В изоляторах больше, чем в полупроводниках. Например, в типич-ных полупроводниках — германии и кремнии ширина запрещенной зоны составляет 1,07∙10–19 и 1,75∙10–19 Дж соответственно, в типичных изоляторах — примерно 10–18 Дж. Строго установить границу между полупроводниками и изоляторами невозможно, поэтому принято считать, что она лежит при значении ширины запрещенной зоны около 2∙10–19 Дж.
На рис. 2.6 схематически представлено расположение уровней валентной зоны и зоны проводимости соответственно у металлов, полупроводников и изоляторов.
Проводники второго рода должны содержать ионы, имеющие определенную подвижность. Многие твердые соли обладают ионной кристаллической решеткой, в узлах которой находятся попеременно положительные и отрицательные ионы. Простейшим примером ионного кристалла является кристалл хлорида натрия собъемноцентрированной кубической решеткой, в узлах которой находятся ноны натрия и хлора.
При плавлении кристаллическая решётка твердого ионного кристалла разрушается, и ионы получают способность к беспорядочному передвижению. В свою очередь, такая способность к движению может приводить к образованию комплексов и ассоциатов. Если при плавлении хлорида натрия комплексов практически не образуется, то, например, при плавлении хлорида кадмия образуются ионы CdCl+ и CdCl3– по реакции:
2CdCl2 = CdCl+ +CdCl3–
Еще более сложные взаимодействия происходят при плавлении смеси двух соединений. В этом случае возможность или невозможность образования комплексов определяется природой всех сортов ионов в расплаве. А. Ф. Алабышев с сотрудниками, изучавшие взаимодействие в расплавах РbС12 — LiCl, РbС12 — NaCl, РbСl2 — КСl и РbСl2 — RbCl, установили, что в первом расплаве комплексных ионов РbС13– практически не образуется. По мере перехода от LiCl к RbCl концентрация комплексного иона РbС13– в соответствии с реакцией
МС1 + РbС12 = PbCl3– + M+
все больше и больше увеличивается. Это связано с тем, что с ро-стом размера иона щелочного металла его способность удерживать анионы хлора уменьшается и вероятность образования комплекса возрастает.
Комплексные соединения могут образовываться и при добавлении в расплав посторонней соли. Так, если к расплаву Cd(NO3)2 — NaNO3 — KNO3, в котором не образуются комплексы, добавлять бромид калия, то, согласно Бокрису, кадмий и бром будут образовывать комплексные ионы, причем содержание ионов брома в окружении ионов кадмия будет тем больше, чем больше добавка бромида калия. Чем выше концентрация бромида калия, тем большее число ионов кадмия связано в CdBr3– и тем меньше простых ионов кадмия, ионов CdBr+ и нейтральных частиц CdBr2.
Криолит Na3AlF6 (или 3NaF∙AlF3) при плавлении распадается не на простые ионы Na+, А13+ и F–, а, как установил П. П. Фе-дотьев, по реакции:
Na3AlF6 = 3Na+ + AlF63–
Если же к криолиту добавить глинозем, т. е. получить расплав, применяющийся в процессе электролитического получения алюминия, то произойдет дальнейшее взаимодействие с образованием оксифторидных ионов по реакции:
AlF63– + Al2O3 = 3AlOF2–
При растворении какого-нибудь вещества в растворителе, не проводящем ток, например в воде или органическом растворителе, могут, образовываться как молекулярные, так и ионные растворы.
Твердые вещества, обладающие ионными кристаллическими решетками, при растворении переходят в раствор обычно в виде ионов. Это и понятно, ибо при растворении силы взаимодействия между ионами уменьшаются в ε раз (ε — диэлектрическая проницаемость растворителя) и вероятность образования ассоциатов тем меньше, чем больше ε.Наоборот, при растворении веществ, обладающих в твердом состоянии молекулярными или атомными кристаллическими решетками, образуются растворы, совсем не содержащие ионов или содержащие их в незначительных количествах. Например, при растворении в воде сахара образуется раствор, вовсе не проводящий электрический ток и, следовательно, не имеющий ионов, а при растворении. уксусной в воде лишь в незначительной степени распадаются на ионы.
В водном растворе почти все электролиты можно разделить на два больших класса. К одному из них относятся электролиты, хорошо проводящие ток, а к другому — плохо проводящие ток. Первые называются сильными электролитами, а вторые — слабыми электролитами.
Сказанное выше, однако, не является справедливым для всех случаев. Иногда возможны такие взаимодействия между молекулярными компонентами раствора, которые приводят к образованию ионов, и наоборот, в ряде случаев ионы могут образовывать электронейтральные частицы или частицы с меньшим зарядом. Специфические взаимодействия между компонентами могут привести к тому, что какой-нибудь электролит, растворенный в одном растворителе, окажется сильным, а в другом — слабым.
Примером ионообразующих взаимодействий может служить обнаруженное В. А. Избековым взаимодействие между бромидом алюминия и бромидом сурьмы. Оба эти вещества в жидком виде тока не проводят, т. е. не распадаются на ионы. Однако при сливании их друг с другом образуется раствор, довольно хорошо проводящий ток, причем наилучшая проводимость наблюдается при содержании 75% (мол.) бромида сурьмы и 25% (мол.) бромида алюминия. Это объясняется тем, что оба компонента друг с другом образуют химическое соединение Аl(SbBr4)3, которое распадается на ионы: А1(SbВr4)з = А13+ + ЗSbВr4–.
Примером ионоуничтожающих взаимодействий является ассоциация, приводящая к образованию так называемых ионных пар, ионных тройников или квадруполей. Такие образования наиболее вероятны в растворителях с низкими диэлектрическими проницае-мостями.
Процесс растворения какого-либо вещества в растворителе можно в общем случае рассматривать как химическую реакцию взаимодействия растворяемого вещества с растворителем. При достижении равновесия в растворе устанавливаются равновесные концентрации исходных веществ и продуктов реакции. Сам факт установления равновесия наиболее просто интерпретируется, если считать, что скорость реакции, протекающей в прямом направлении, равна скорости обратной реакции и равновесие является динамическим. Изменение концентраций веществ или температуры приводит к нарушению равновесия, так как изменяются скорости реакций, что приводит к установлению новых значений равновесных концентраций.
Наличие большого числа разного типа взаимодействий между частицами раствора приводит к весьма сложным зависимостям, характеризующим состояние и свойства растворов.
Энергия взаимодействия во всех случаях уменьшается с расстоянием между частицами. Поэтому наиболее простые зависимости, характеризующие растворы, могут быть получены для бесконечно разбавленных растворов, когда всеми типами взаимодействий можно пренебречь за исключением взаимодействия между ионами и молекулами растворителя.






